Математическое выражение 2-го закона термодинамики
Энтропия изолированной ТС не изменяется только при равновесных процессах в ней и всегда возрастает при неравновесных процессах. Таким образом, 2-ой закон термодинамики – закон об энтропии и состоит из принципа существования энтропии и принципа возрастания энтропии.
Все равновесные процессы – обратимые, а неравновесные – необратимые процессы. Процесс называется необратимым, если суммарный запас энергии направленного, упорядоченного движения частиц ТС (работы) уменьшается, и обратимым, если этот запас энергии сохраняется. В необратимых процессах происходит диссипация (рассеяние) энергии упорядоченного движения материи в энергию теплового, неупорядоченного движения, которую нельзя превратить ни в какой другой вид энергии в обратном направлении. Обратимый (равновесный) процесс возможен только при бесконечно малых перепадах параметров на границе ТС и окружающей среды в любой момент процесса.
Второй закон термодинамики является обобщением опытных данных, указывает на особый характер протекания тепловых процессов и устанавливает пределы возможных превращений теплоты в работу. Этот закон позволяет определить направление и условия протекания любого термодинамического процесса. Дело в том, что тепловые процессы, удовлетворяющие первому закону термодинамики, подразделяются на самопроизвольные, протекающие без внешнего воздействия в данных условиях и на процессы, которые не могут происходить в данных условиях без внешнего воздействия.
В изолированной ТС самопроизвольные процессы протекают в направлении достижения равновесия системы. При этом работа преобразуется в теплоту (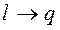 ), а теплота переходит лишь от тела с более высокой температурой к телу с более низкой температурой. Процессы с превращением теплоты в работу (
), а теплота переходит лишь от тела с более высокой температурой к телу с более низкой температурой. Процессы с превращением теплоты в работу (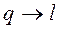 ) в изолированной системе самопроизвольно идти не могут. Открытие 2-го закона термодинамики было связано с анализом работы тепловых машин (Сади Карно).
) в изолированной системе самопроизвольно идти не могут. Открытие 2-го закона термодинамики было связано с анализом работы тепловых машин (Сади Карно).
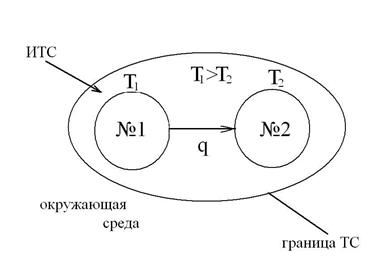
Для осуществления процессов с превращением теплоты в работу надо создать из двух тел с различной температурой (Т1>Т2) неравновесную ТС, обладающую запасом энергии направленного упорядоченного движения частиц, а также осуществить с помощью термодинамического рабочего тела (ТРТ) обратимый цикл и передать результирующую работу цикла lц третьему телу – аккумулятору работы. При этом всю подведенную теплоту q1 нельзя превратить в работу lц. Часть теплоты необходимо отвести в холодильник 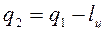 .
.
Схему превращения теплоты в работу можно представить в виде 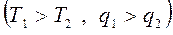 :
:
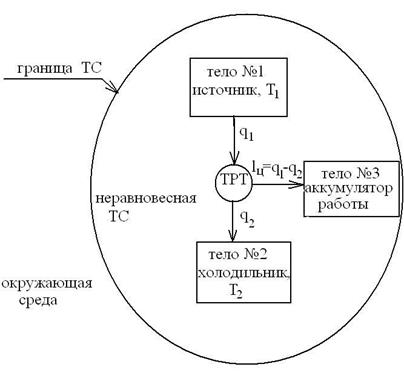
Неравноценность превращений работы в теплоту и теплоты в работу объясняется тем, что энергию направленного движения частиц (работу) можно превратить в тепловую энергию неупорядоченного, хаотического движения частиц, а обратный процесс возможен только при наличии соответствующей компенсации.
Наиболее краткой формулировкой 2-го закона термодинамики является формулировка Томсона-Кельвина: «Теплота, содержащаяся в окружающей среде, не может быть превращена в работу теплового двигателя, если температура всех окружающих тел будет одинаковой, т. е. вечный двигатель II рода неосуществим». Вечный двигатель II рода – это двигатель, который производил бы механическую работу исключительно за счет теплоты окружающей среды с одинаковой температурой во всех ее точках.
6.2. Математическое выражение 2-го закона термодинамики. Три составляющие изменения энтропии термодинамической системы
Энтропия равновесного процесса S — это функция состояния и ее дифференциал dS — полный дифференциал
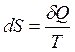 , [
, [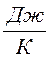 ] и
] и 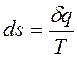 , [
, [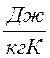 ].
].
Температура Т на границе ТС, где подводится теплота, есть интегрирующий делитель, превращающий неполный дифференциал – теплоту в полный дифференциал – энтропию. Для равновесного кругового процесса ∮![]() ∮
∮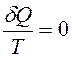 — интеграл Клаузиуса.
— интеграл Клаузиуса.
У всякой ТС существует однозначная функция состояния – энтропия, которая при адиабатных равновесных процессах не изменяется.
Для сложной открытой ТС, которая взаимодействует с окружающей средой, изменение энтропии dS связано с подводом теплоты 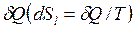 , с протеканием процессов внутри ТС
, с протеканием процессов внутри ТС 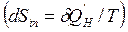 и с подводом массы вещества
и с подводом массы вещества 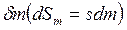 :
:
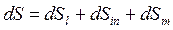 , Дж/К.
, Дж/К.
Для процессов, протекающих внутри ТС, ![]() — «некомпенсируемая теплота» (Клаузиус), в которую превращается количество работы вследствие необратимости (неравновесности) процессов внутри системы.
— «некомпенсируемая теплота» (Клаузиус), в которую превращается количество работы вследствие необратимости (неравновесности) процессов внутри системы.
Если границу ТС пересекают несколько веществ с массами mi , то изменение энтропии за счет ее подвода извне будет равно:
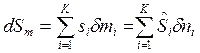 .
.
Для обратимых процессов при подводе теплоты ![]() извне изменение энтропии ТС равно изменению энтропии окружающей среды с обратным знаком, т. е.
извне изменение энтропии ТС равно изменению энтропии окружающей среды с обратным знаком, т. е.
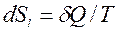 ,
,
а в случае необратимых процессов
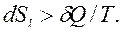
При протекании процессов внутри ТС энтропия может только расти, т. е. dSin>0.
При этом количество энергии упорядоченного движения частиц, которое диссипировало в тепловую энергию, равно: 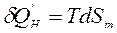 . Тогда математическое выражение второго закона термодинамики для сложной открытой ТС примет вид:
. Тогда математическое выражение второго закона термодинамики для сложной открытой ТС примет вид:
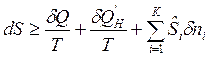 ,
,
где знак «=» для равновесных процессов, а знак «>» для неравновесных процессов.
Знак неравенства показывает, что изменение энтропии больше величины 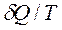 .
.
Для закрытой ТС dSm=0 и математическое выражение 2-го закона термодинамики будет иметь вид:
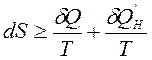 .
.
Для неравновесного кругового процесса
∮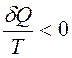 , т. е. круговой интеграл по неравновесному пути не определяет изменение энтропии в круговом процессе (цикле), а меньше его. (Для равновесного кругового процесса ∮
, т. е. круговой интеграл по неравновесному пути не определяет изменение энтропии в круговом процессе (цикле), а меньше его. (Для равновесного кругового процесса ∮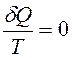 ).
).
В качестве примера, характеризующего возрастание энтропии при неравновесных процессах, рассмотрим самопроизвольный переход теплоты от горячего тела №1 с температурой Т1 к холодному телу №2 с температурой Т2, приведя их в контакт и рассматривая систему из этих тел, как изолированную ТС, в соответствии со следующей схемой: