Методичка по молекулярной физике
В физической лаборатории студенты изучают основные физические явления; овладевают навыками экспериментальных исследований, обработки и анализа полученных результатов; знакомятся с устройством и работой современных приборов.
Целью методических указаний к лабораторному практикуму по дисциплине «Физика» является оказание студентам помощи в подготовке к лабораторным работам и приобретении практических навыков проведения экспериментальных опытов и обработке результатов эксперимента.
Каждая лабораторная работа включает в себя общие сведения по теме занятия, методику проведения опытов, контрольные вопросы.
При подготовке к лабораторной работе необходимо изучить теоретическую часть, касающуюся данной работы, которая подробно изложена в методических указаниях и литературе для самоподготовки, которая приведена в данных методических указаниях.
Каждый студент выполняет работы согласно графику. Подготовка к лабораторным работам проводится студентами в часы, отведенные для самостоятельной работы. При подготовке к лабораторной работе студент обязан оформить конспект лабораторной работы: название и цель работы, записать основные формулы для расчетов, зарисовать принципиальную или рабочую схему установки. Результаты лабораторной работы студенты оформляют в виде отчета (приложение А). При защите лабораторной работы студент излагает не только суть данной работы и констатирует конечный результат, но также даёт исчерпывающие ответы на контрольные вопросы.
Перед началом лабораторной работы преподаватель контролирует подготовку студента к выполнению работы: проверяет составленный конспект работы, проводит собеседование. Студенты, не готовые к проведению лабораторной работы, к выполнению работы не допускаются.
После выполнения всех опытов и оформления работа сдается на проверку преподавателю в день проведения лабораторной работы. По каждой лабораторной работе проводится защита. В защиту включены основные вопросы по теме лабораторной работы. Отдельно выставляется балл за подготовку, выполнение и защиту каждой работы. Количество баллов, проставляемое за каждый вид деятельности, утверждается в начале семестра на заседании кафедры и доводится до сведения студента.
1 ГАЗОВЫЕ ЗАКОНЫ
Для описания поведения молекулярных систем пользуются моделью идеального газа.
Идеальный газ — это газ, молекулы которого имеют пренебрежимо малый собственный объем и не взаимодействуют на расстоянии. Многие газы, в том числе воздух, уже при нормальных условиях можно считать идеальными.
Уравнение состояния идеального газа.
Величины, определяющие состояние газа, называются параметрами состояния: р – давление, V – объем, Т – температура, S – энтропия и др. Данные величины не являются независимыми. Зависимость, связывающая параметры системы, называется уравнением состояния.
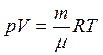 , (1.1)
, (1.1)
где р – давление газа,
V – объем,
Т – температура,
т – масса,
μ – масса моля вещества,
![]() — число молей вещества в объеме,
— число молей вещества в объеме,
R – универсальная газовая постоянная (R = 8,31 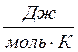 )
)
Данное уравнение носит название уравнение Менделеева — Клайперона.
При всех процессах выполняется первый закон термодинамики:
![]() , (1.2)
, (1.2)
где ![]() — теплота, подводимая газу,
— теплота, подводимая газу,
С – теплоемкость газа, которая зависит от вида процесса,
![]() — работа, совершаемая газом,
— работа, совершаемая газом,
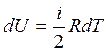 — изменение внутренней энергии идеального газа (выражение записано для одного моля)
— изменение внутренней энергии идеального газа (выражение записано для одного моля)
i — число степеней свободы молекул данного газа.
Изопроцессы.
Рассмотрим некоторые процессы с идеальным газом. Все уравнения и расчеты будем проводить для одного моля.
Изохорический процесс.
Уравнение процесса: 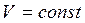 ,
, 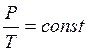 .
.
Так как объем газа не изменяется, то работу газ не совершает: 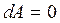 . Подводимое к системе тепло идет на изменение внутренней энергии
. Подводимое к системе тепло идет на изменение внутренней энергии 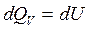 . Молярная теплоемкость при этом процессе:
. Молярная теплоемкость при этом процессе:
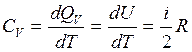 (1.3)
(1.3)
Изобарический процесс.
Уравнение процесса: 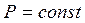 ,
, 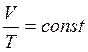 .
.
Применив первый закон термодинамики (1.2), имеем:
![]() (1.4)
(1.4)
Установим связь между СV и СР , для чего продифференцируем уравнение Менделеева – Клайперона (1.1) : 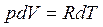 подставим в уравнение (1.4) и получим уравнение Майера:
подставим в уравнение (1.4) и получим уравнение Майера:
СР = СV +R (1.5)
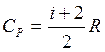 (1.6)
(1.6)
Работа при изобарическом процессе:
А = р(V2 – V1) (1.7)
Изотермический процесс.
Уравнение процесса: 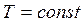 ,
, 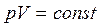 .
.
Внутренняя энергия в данном процессе не изменяется dU = 0, так как 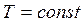 . Теплоемкость процесса СТ → ∞. Подводимое тепло к системе идет на совершение работы:
. Теплоемкость процесса СТ → ∞. Подводимое тепло к системе идет на совершение работы: ![]() .
.
Работа при изотермическом процессе:
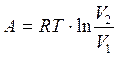 (1.8)
(1.8)
Адиабатический процесс.
Это процесс происходящий без теплообмена с окружающей средой: 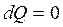 .
.
Энтропия системы: 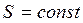 , так как
, так как 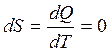 .
.
Теплоемкость процесса: 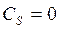 .
.
При адиабатическом расширений газ совершает работу за счет внутренней энергии и охлаждается. Из первого начала термодинамики (1.2) имеем:
![]() или
или 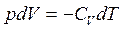 (1.9)
(1.9)
Для того, чтобы исключить из выражения (1.9) температуры, продифференцируем уравнение состояния (1.1):
![]() (1.10)
(1.10)
Выразим dT и подставим в (1.9), с учетом уравнения Майера (1.5), получаем:
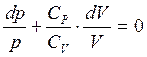 (1.11)
(1.11)
Обозначив
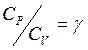 (1.12)
(1.12)
Проинтегрируем выражение (1.11):
![]()
или, окончательно, уравнение адиабатического процесса (уравнение Пуассона) примет вид:
![]() , (1.13)
, (1.13)
где ![]() — показатель адиабаты.
— показатель адиабаты.
Подставим в уравнение (1.12) выражение теплоемкостей СV — (3) и СР – (1.6), имеем:
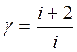 (1.14)
(1.14)
Т. е. показатель адиабаты определяется природой газа.
Работа адиабатного процесса:
![]() (1.15)
(1.15)
1.1 ЛАБОРАТОРНАЯ РАБОТА № 1. ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ 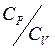 МЕТОДОМ СТОЯЧИХ ЗВУКОВЫХ ВОЛН
МЕТОДОМ СТОЯЧИХ ЗВУКОВЫХ ВОЛН
Цель работы: Определение показателя адиабаты методом стоячих звуковых волн.
Задание: Проработать материал теоретической части, выполнить опыты экспериментальной части, оформить отчет, ответить на контрольные вопросы, защитить работу.
Оборудование и материалы: Генератор звуковых волн ЗГ, осциллограф, прибор для определения скорости звуковых волн.
1.1.1 Описание установки
|
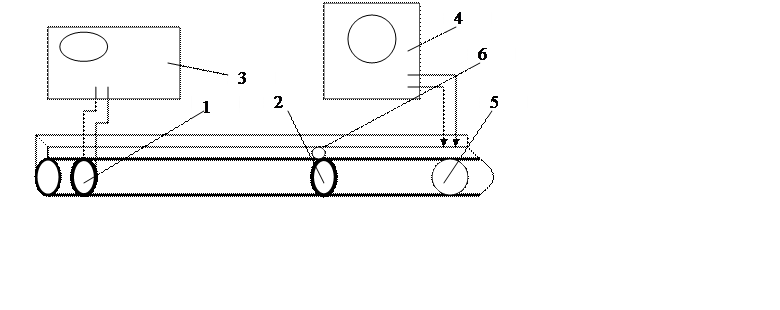
Прибор представляет собой горизонтальную металлическую трубу, внутри которой находятся телефон 1 и микрофон 2. На телефон подается напряжение звуковой частоты ν от звукового генератора 3. В трубе устанавливается стоячая звуковая волна. Вращая барабан 5, перемещают микрофон внутри трубы. С микрофоном связан указатель 6. Звуковые колебания преобразуются в микрофоне в электрические сигналы, которые подаются на вход осциллографа 4. Перемещая микрофон внутри трубы, находят положение, при котором амплитуда синусоидального сигнала на экране осциллографа максимальна, что соответствует нахождению микрофона в координате пучности стоячей звуковой волны. При этом расстояние между телефоном и микрофоном кратно целому числу полуволн.
1.1.2 Теоретическое обоснование метода
В данной работе определяется коэффициент Пуассона методом стоячих звуковых волн. Стоячая волна образуется в результате интерференции двух синусоидальных волн, обладающих одинаковыми амплитудами, частотами, направлениями колебаний и распространяющихся навстречу друг другу. Обе эти волны, в отличие от стоячих, называют бегущими волнами.
Уравнения колебаний точки с координатой х, вызванной прямой и обратной волнами, определяется формулами:
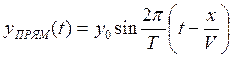
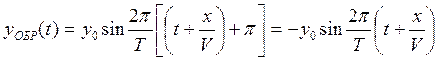 , (1.16)
, (1.16)
где Т – период колебаний.
В результате интерференции прямой и обратной волн колебания точки будут происходить по закону:
![]()
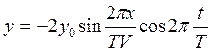 (1.17)
(1.17)
где
![]() (1.18)
(1.18)
λ — длина стоячей волны.
Тогда уравнение (1.17) имеет вид:
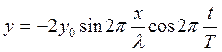 (1.19)
(1.19)
Уравнение (1.19) является уравнением стоячей волны, а множитель
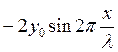 (1.20)
(1.20)
её амплитудой, не зависящей от времени, определяемой лишь координатой х точки.
Точки, в которых амплитуда максимальная, называются пучностями.
Точки, в которых амплитуда равна нулю, в колебаниях не участвуют и называются узлами.
Расстояние между двумя пучностями – Δl можно найти из условия максимального значения амплитуды (1.20). Если 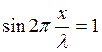 , то
, то
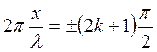 (1.21)
(1.21)
где k = 1,2,3,…
Следовательно, координаты пучностей:
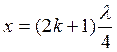 (1.22)
(1.22)
Тогда расстояние между соседними пучностями.
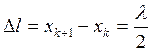 (1.23)
(1.23)
Таким образом расстояние между соседними пучностями равно половине длины волны.
Звуковые волны являются продольными волнами сжатия и растяжения среды. Скорость распространения бегущей звуковой волны зависит тот упругости среды.
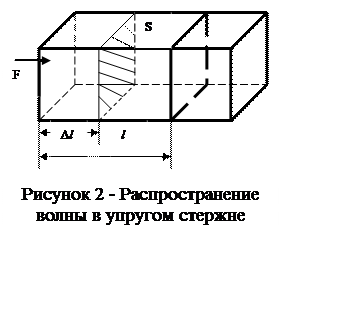
Рассмотрим распространение волны в упругом стержне (рис.2.). Пусть поперечное сечение стержня S действует деформирующая сила F. За время Δt под действием этой силы конец стержня сместился на расстояние Δl, а волна распространилась на расстояние l . Тогда скорость частиц стержня
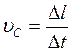 (1.24)
(1.24)
скорость распространения волны
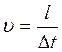 (1.25)
(1.25)
Так как за время Δt деформировалась только часть стержня, равная Δl, то, применяя к этой части закон Гука, получим:
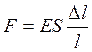 , (1.26)
, (1.26)
где Е – модуль Юнга.
Импульс деформирующей силы за время Δt равен:
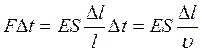 (1.27)
(1.27)
Импульс, сообщенный данной силой, деформированной части стержня равен mυc, а масса этой части стержня m = ρ∙S∙l , где ρ – первоначальная плотность стержня. Тогда:
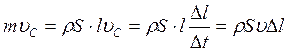 (1.28)
(1.28)
На основании II закона Ньютона 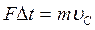 , используя (1.27) и (1.28) имеем
, используя (1.27) и (1.28) имеем
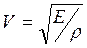 (1.29)
(1.29)
Запишем закон Гука в виде: 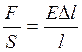 , где
, где 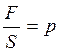 — давление на поперечное сечение стержня.
— давление на поперечное сечение стержня.
Если деформацией поперечного сечения можно пренебречь, то относительное изменение длины равно относительному изменению объема.
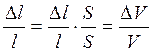 тогда
тогда  (1.30)
(1.30)
Рассматривая распространение звуковой волны в газе, находящемся в закрытом сосуде постоянного сечения, полагая изменения объема бесконечно малыми и принимая во внимание, что увеличению давления соответствует уменьшение объема, перепишем уравнение (1.30) в виде:
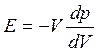 (1.31)
(1.31)
При рассмотрении волн в газовой среде в следствии сжатия и разряжения происходит изменение температуры различных участков. Так как частота звуковой волны достаточно велика, то температуры участков не будут успевать выравниваться и процесс распространения звуковой волны можно считать происходящим без теплообмена т. е. адиабатическим.
Адиабатический процесс описывается уравнением Пуассона
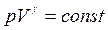 , (1.32)
, (1.32)
где 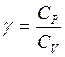 . Дифференцируя уравнение (1.32), получим
. Дифференцируя уравнение (1.32), получим
![]()
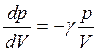 (1.33)
(1.33)
Подставляя выражение (1.33) в (1.31), получим:
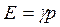 (1.34)
(1.34)
Выразив плотность газа ρ из уравнения Менделеева – Клапейрона 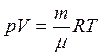 , имеем:
, имеем:
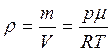 (1.35)
(1.35)
Подставляя в уравнение (1.29) выражения (1.32) и (1.35), получим:
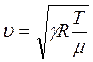 откуда
откуда 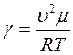 (1.36)
(1.36)
Таким образом, определение γ сводиться к измерению скорости звука и абсолютной температуры воздуха.
В данной работе скорость определяется методом стоячих звуковых волн.
1.1.3 Порядок выполнения работы
1. Готовят установку (рис.1) к работе. Устанавливают на звуковом генераторе частоту 1000 Гц и напряжение на выходе не более 2 В. Добиваются на осциллографе 4 четкого и устойчивого изображения синусоиды.
2. Вращают барабан 5, перемещая микрофон 2 вдоль трубы. Записывают по указателю 6 координаты – хk микрофона, соответствующие наибольшему сигналу на экране осциллографа. Измерения производят по всей длине трубы.
3. Рассчитывают длину звуковой волны
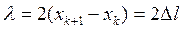 (1.37)
(1.37)
4. Вычисляют скорость звуковой волны, распространяющейся в трубе:
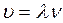 , (1.38)
, (1.38)
где ![]() — частота звуковой волны.
— частота звуковой волны.
5. Определяют по термометру температуру воздуха Т в лаборатории и по формуле (1.36) рассчитывают показатель адиабаты.
6. Результаты измерений и вычислений заносят в таблицу 1.
7. Измерения и расчеты (пункты 1 — 6) повторяют для частот 1500 Гц и 2000 Гц.
Таблица 1 – Определение показателя адиабаты
|
№ |
Δl(м) |
ν(Гц) |
λ(м) |
υ(м/с) |
υСР(м/с) |
Δυ (м/с) |
γ |
γСР |
Δγ |
8. Производят расчет: λ, υ, γ.
9. Вычисляют погрешность методом косвенных измерений.
1.1.4 Контрольные вопросы
1. Дайте определение адиабатному процессу, условия протекания адиабатного процесса.
2. Почему процесс распространения звука в воздухе можно считать адиабатическим?
3. Как в данной работе определяется длина волны?
4. Почему с увеличением частоты ν увеличивается число максимумов, наблюдаемых на осциллографе?
5. Каков смысл показателя адиабаты?
2 ФИЗИЧЕСКИЕ ОСНОВЫ ТЕРМОДИНАМИКИ
Слово термодинамика состоит из двух греческих слов: «терме» — «теплота» и «динамис» — «сила».
Термодинамика возникла как наука о превращении тепла в механическое движение, в работу. В процессе своего развития термодинамика расширилась и приобрела характер фундаментальной физической науки. Объектом ее исследования являются практически все любые процессы превращения материи, связанные с выделением или поглощением энергии, совершением работы, переносом вещества и т. д. Термодинамика изучает процессы расширения и сжатия, плавления и кристаллизации, химические реакции, тепловое излучение и т. д. По отношению ко всем этим процессам термодинамика отвечает на три главных вопроса:
1) Возможен ли данный процесс при данных условиях?
2) Если процесс возможен, то в каком направлении (тоже, конечно, при данных условиях) он пройдет?
3) Чем процесс закончиться? Это окончательное, не зависящее от времени, состояние термодинамики называют состоянием теплового равновесия.
На эти вопросы термодинамика отвечает с помощью трех законов, составляющих ее основное содержание.
Первый закон термодинамики.
Первый закон термодинамики утверждает, что всякое тело обладает внутренней энергией U , причем внутренняя энергия может уменьшиться, если тело совершает работу А, и увеличиться, если ему сообщат теплоту Q.
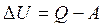 (2.1)
(2.1)
Первый закон термодинамики – это закон сохранения энергии. Из него, в частности, следует, что если внутренняя энергия тела постоянна ΔU = 0 и тело не получает и не отдает тепла Q = 0, то оно не может совершить работу. Таким образом нельзя получить работу из ничего или превратить ее ни во что. Устройство или машину, получающую работу из ничего называют вечным двигателем первого рода. Первый закон термодинамики отвергает вечный двигатель первого рода.
При решении практических задач первый закон термодинамики имеет вид:
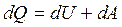 (2.2)
(2.2)
Теплота dQ, сообщаемая системе, расходуется на увеличение внутренней энергии системы dU и на совершение системой работы dA против внешних сил.
Где U – внутренняя энергия системы, т. е. сумма всех видов кинетической и потенциальной энергии всех частей системы: молекул, атомов, электронов и т. д. (для идеального газа внутренняя энергия представляет собой только кинетическую энергию хаотического теплового движения молекул).
dQ – теплота, подводимая к системе.
dA – работа газа против сил внешнего давления.
![]()
где р — внешнее давление,
dV – приращение объема газа.
Рассмотрим первый закон термодинамики в применении к изопроцессам для одного киломоля газа.
Изопроцессами – называют термодинамические процессы, протекающие при постоянном значении одного из параметров состояния.
Изохорный процесс – процесс протекает при V = const, т. е. dV =0 , ![]()
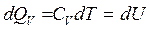 (2.3)
(2.3)
т. е. все тепло, подводимое к системе, идет на увеличение ее внутренней энергии – нагревание системы;
где CV – удельная теплоемкость газа при постоянном объеме – физическая величина, численно равная количеству теплоты dQV, которое нужно сообщить единице массы газа (1 кг), чтобы нагреть ее на 1˚К при постоянном объеме.
Молярная теплоемкость при постоянном объеме Cv – теплоемкость одного киломоля:
Cv = μCV
где μ – молярная масса.
При изохорном процессе:
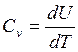 (2.4)
(2.4)
Отсюда внутренняя энергия киломоля газа:
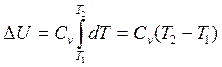 (2.5)
(2.5)
Для любой массы газа т
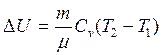 (2.6)
(2.6)
Изобарный процесс – процесс, протекающий при постоянном давлении p = const, т. е. dp = 0. В этом случае количество тепла, подводимое к системе:
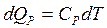 , (2.7)
, (2.7)
где Ср – удельная теплоемкость газа при постоянном давлении – физическая величина, численно равная количеству тепла dQр, которое надо сообщить единице массы газа, чтобы нагреть ее на 1˚К при постоянном давлении.
Первое начало термодинамики для изобарного процесса запишется так:
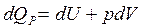 (2.8)
(2.8)
из формул (2.4) и (2.7)
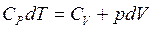 (2.9)
(2.9)
Поделив все на dT, получим: 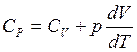
из уравнения состояния газов ![]() , учитывая, что p = const и dp = 0 имеем:
, учитывая, что p = const и dp = 0 имеем:
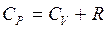 (2.10)
(2.10)
Формула (2.10) – уравнение Майера, показывает, что при нагревании одного моля газа при изобарном процессе часть теплоты, равная Cv, идет на увеличение внутренней энергии газа, а часть, равная R – на работу против внешних сил.
При изобарном процессе газ не только нагревается, но и расширяется и совершает работу по преодолению внешнего давления.
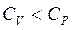 (2.11)
(2.11)
Изотермический процесс – процесс, протекающий при постоянной температуре T = const, dT =0 тогда dU = 0.
Первый закон термодинамики запишется так:
![]()
Тепло в этом случае идет только на совершение работы против внешних сил. Внутренняя энергия при изотермическом процессе остается без изменения U = const.
Адиабатный процесс – это процесс, который протекает без теплообмена с окружающей средой.
Для адиабатного процесса первый закон термодинамики имеет вид:
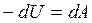 или
или 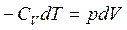 (2.12)
(2.12)
т. е. внешняя работа совершается за счет внутренней энергии системы. Если система расширяется, то ее температура понижается, т. к. уменьшается ее внутренняя энергия.
Для адиабатного процесса имеет место уравнение Пуассона:
![]() , (2.13)
, (2.13)
где 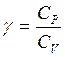 — показатель адиабаты (Пуассона).
— показатель адиабаты (Пуассона).
Второй закон термодинамики.
Идея второго закона термодинамики связанна с именем французского инженера С. Карно, который разработал цикл Карно – круговой процесс в тепловой машине, в результате которого тело, совершив работу, затем возвращается в исходное состояние, используя часть этой работы. Он показал, что полезную работу можно получить лишь в случае, когда тепло передается от нагретого тела к более холодному.
Развивая идеи Карно, английский физик У. Томсон в 1851 г. сформулировал второй закон термодинамики: «В природе не возможен процесс, единственным результатом которого была бы механическая работа, полученная за счет охлаждения теплового резервуара». Эта формулировка показывает, что взаимное превращение тепла и работы неравномерно: работу можно полностью превратить в тепло (путем трения, нагрева электрическим током и т. д.), а тепло полностью превратить в работу нельзя. Машину, многократно и полностью превращающую тепло в работу, называют вечным двигателем второго рода. Второй закон термодинамики отвергает вечный двигатель второго рода.
Действительно, первый закон термодинамики не запрещает указанный переход тепла (лишь бы выполнялся закон сохранения энергии), однако этого не происходит. Газы перемешиваются в сосуде, но сами не разделяются в сосуде; кусок сахара растворяется в воде, но не выделится обратно в виде куска и т. д.
Клаузиус решил вопрос о направлении самопроизвольных процессов в 1865 г., когда ввел новую функцию – энтропию, установив ее важнейшую особенность: в теплоизолированных системах самопроизвольно процессы идут в сторону увеличения энтропии. В состоянии теплового равновесия энтропия достигает максимума. Эта функция является мерой беспорядка в системе: таким образом, самопроизвольные процессы идут в сторону увеличения беспорядка.
Энтропией называется функция dS состояния системы, дифференциал которой в элементарном, обратимом процессе равен отношению бесконечно малого количества тепла dQ сообщенного системе, к абсолютной температуре последней Т:
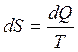 ,
, 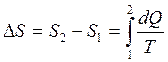 (2.14)
(2.14)
Формула (2.14) дает возможность подсчитать только изменение энтропии. По закону изменения энтропии системы в обратимом процессе можно судить о направлении теплообмена (при нагревании тела энтропия возрастает S2>S1 , при охлаждении убывает S2<S1). При равновесных процессах dQ = 0 и S2 = S1= const – энтропия не изменяется. При других процессах – изохорном, изобарном, изотермическом – энтропия изменяется. В частности при равновесном изотермическом процессе T = const изменение энтропии равно:
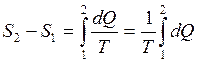 (2.15)
(2.15)
В замкнутых термодинамических системах энтропия возрастает, либо равна нулю и уравнение запишется в общем случае так:
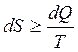 ;
; 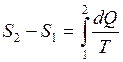
Знак равенства относится к обратимым процессам, а знак неравенства — к необратимым. Так как все реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению энтропии.
Возможность расчета абсолютной величины энтропии связанна с именем физика – химика В. Нернста. В 1906г. он установил, что когда температура стремится к абсолютному нулю, изменение энтропии, связанное с любым превращением, так же стремиться к нулю. Позднее было показано, что и абсолютное значение энтропии простых кристаллических тел стремиться к нулю при Т→ 0. это третий закон термодинамики.
Вводя внутреннюю энергию, энтропию и другие функции, термодинамика не интересуется природой и ней связывает их с устройством тел, с тем, из каких частиц тела состоят, какими свойствами частицы обладают, как они взаимодействуют между собой. В ней основные законы вводятся как постулаты, являющиеся обобщением многовекового опыта человечества. Поэтому они оказываются справедливыми для любых процессов и для любых веществ: твердых, жидких, газообразных, плазмы, металлов, полупроводников.
2.1 ЛАБОРАТОРНАЯ РАБОТА № 2. ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОТЫ ПАРООБРАЗОВАНИЯ ВОДЫ
Цель работы: Приобрести практические навыки измерения температуры и массы тел. Проверить экспериментально значение табличного данного удельной теплоты парообразования воды.
Задание: Проработать материал теоретической части, выполнить опыты экспериментальной части, оформить отчет, ответить на контрольные вопросы, защитить работу.
Оборудование и материалы: Калориметр, колба для нагревания воды, весы и разновес.
2.1.1 Описание установки
Для получения пара используется колба с водой, закрытая пробкой с резиновой трубкой для отвода пара в калориметр с холодной водой. Колба устанавливается на электроплитку.
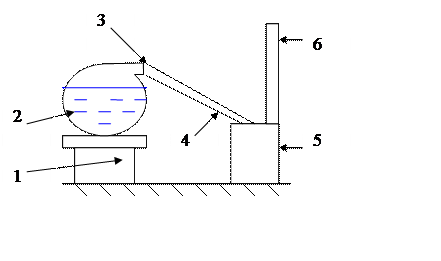
1 – электроплитка,
2 – колба с водой,
3 – резиновая пробка с трубкой для отвода пара,
4 – резиновая трубка со стеклянным наконечником,
5 – калориметр,
6 – термометр.
Рисунок 3 – Оборудование для определения удельной теплоты парообразования
2.1.2 Теоретическое обоснование метода
Удельную теплоту парообразования можно определить калометрическим методом. Для этого, пользуясь законом сохранения энергии, нужно составить уравнение теплового баланса. При проведении эксперимента наблюдается явление теплообмена. Холодная вода и внутренний сосуд калориметра нагреваясь поглощают тепло; при конденсации пара и охлаждении воды, полученной из пара, тепло выделяется.
Количество теплоты, полученное алюминиевым калориметром равно
![]() , (2.16)
, (2.16)
где с1 – удельная теплоемкость алюминия, равная 880 Дж/(кг∙К),
т1 – масса калориметра,
t1 и t2 – начальная и конечная температуры.
Количество теплоты, полученное водой равно:
![]() , (2.17)
, (2.17)
где с2 – удельная теплоемкость воды, равная 4200 Дж/(кг∙К),
т2 – масса воды в калориметре.
Количество теплоты отданное паром при конденсации равно:
![]() , (2.18)
, (2.18)
где r – удельная теплота парообразования,
т3 – масса пара.
Количество теплоты, отданное водой, полученной из пара при охлаждении равно:
![]() (2.19)
(2.19)
Уравнение теплового баланса:
![]() (2.20)
(2.20)
Подставив в (2.20) значения Q1, Q2 , Q3, Q4 , и получают:
![]()
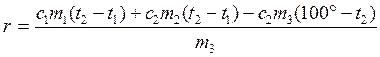 (2.21)
(2.21)
По формуле (2.21) рассчитывают удельную теплоту парообразования.
2.1.3 Порядок выполнения работы
1. Взвешивают калориметр (маленький сосуд) массой т1.
2. Взвешивают воду в калориметре т2.
3. Измеряют температуру воды, помещая термометр в воду на 3 – 4 минуты, причем показания снимают, не вынимая термометр из воды.
4. Нагревают воду до кипения.
5. Отводят пар в калориметр (опуская стеклянную трубку в воду).
6. Тщательно перемешивают воду в калориметре и измеряют ее температуру.
7. Взвешивают калориметр с водой после опыта и определяют массу пара:
![]()
Результаты заносят в таблицу 2.
Таблица 2 – Определение удельной теплоты парообразования.
|
№ |
т1 (кг) |
т2 (кг) |
т΄2 (кг) |
т3 (кг) |
t1˚ |
t2˚ |
r (Дж/кг) |
rср (Дж/кг) |
Опыт повторят три раза.
8. Вычисляют погрешности методом косвенных измерений
![]()
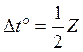 ,
,
где Ζ – цена деления термометра.
9. Записывают конечный результат:
![]()
2.1.4 Контрольные вопросы
1. Какой процесс изучается в данной работе?
2. Что называется удельной теплотой парообразования?
3. Какой закон применяется при выводе расчетной формулы для r?
4. Охарактеризовать процесс испарения и кипения.
5. Изменится ли значение r, если процесс протекает при давлении в 2 раза большем атмосферного?
2.2 ЛАБОРАТОРНАЯ РАБОТА № 3. ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОТЫ ПЛАВЛЕНИЯ ОЛОВА И ВОЗРАСТАНИЯ ЭНТРОПИИ ПРИ НАГРЕВАНИИ И ПЛАВЛЕНИИ ОЛОВА.
Цель работы: Проверить экспериментально значение табличного данного удельной теплоты плавления олова; научиться по экспериментальным данным рассчитывать изменение энтропии.
Задание: Проработать материал теоретической части, выполнить опыты экспериментальной части, оформить отчет, ответить на контрольные вопросы, защитить работу.
Оборудование и материалы: Тигельная печь, тигель с оловом, металлический термометр, секундомер.
2.2.1 Описание установки
Установка собрана из тигельной печи – 3, в которую помещен тигель с оловом – 2. Температуру измеряют милливольтметром – 1, шкала которого проградуирована в градусах. Подогрев печи осуществляется источником тока при замыкании ключа – 4.
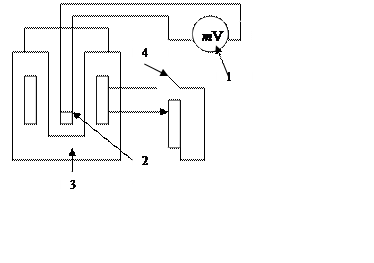 |
Рисунок 4 – Установка для определения удельной теплоты плавления
2.2.2 Теоретическое обоснование метода
Для определения удельной теплоты плавления в данной работе используют графический метод. По данным графика зависимости температуры от времени (рис.5) рассчитывают количество теплоты, потребляемое оловом и тиглем на участках АВ, ВС, СD за равные промежутки времени.
![]()
 Участок АВ – соответствует нагреванию олова и тигля от Т1 до Т2. Участок ВС – соответствует плавлению олова. При плавлении кристаллических веществ температура плавления остается постоянной ее называют точкой плавления вещества.
Участок АВ – соответствует нагреванию олова и тигля от Т1 до Т2. Участок ВС – соответствует плавлению олова. При плавлении кристаллических веществ температура плавления остается постоянной ее называют точкой плавления вещества.
Плавлением называется переход вещества из твердого состояния в жидкое. Плавление сопровождается поглощением тепла:
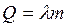 , (2.22)
, (2.22)
где λ – удельная теплота плавления.
Удельной теплотой плавления называется количество теплоты необходимое для превращения при температуре плавления 1 кг твердого вещества в жидкость.
Участок СD – соответствует нагреванию жидкого олова и тигля от Т2 до Т3 . так как промежутки времени, затраченные на нагревание на участке АВ, плавление ВС и нагревание на СD, то количество теплоты, затраченное на плавление олова можно определить зная Q1 и Q3– количество теплоты, затраченное на участках АВ и СD.
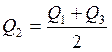 (2.23)
(2.23)
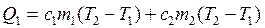 (2.24)
(2.24)
где т1 и т2 – соответственно массы олова и тигля,
с1 и с2 – удельные теплоемкости.
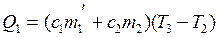 (2.25)
(2.25)
где с1/ — удельная теплоемкость жидкого олова.
Подставив значения (2.22), (2.24) и (2.25) в (2.23), получают:
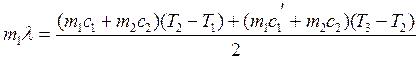
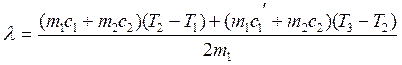 (2.26)
(2.26)
Приращение энтропии при плавлении олова рассчитывают следующим образом:
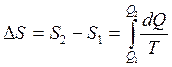
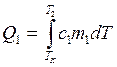 ,
,
где ТК – комнатная температура.
![]()
тогда
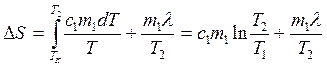 (2.27)
(2.27)
2.2.3 Порядок выполнения работы
1. Включают печь в сеть и измеряют температуру через каждые 30 секунд.(не менее 40 данных.
2. Данные опыта заносят в таблицу 3.
Таблица 3- Зависимость температуры при плавлении олова от времени
|
t (сек) |
30 |
60 |
90 |
……. |
|
t ˚C |
||||
|
T ˚K |
3. Вычерчивают график зависимости Т от времени 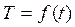 .
.
4. На графике выделяют участок ВС и влево, и вправо откладывают равные промежутки времени.
5. По графику определяют температуры Т1 , Т2 и Т3.
6. Поставляя данные опыта в (2.26), вычисляют λ.
т1 = 74,5 ∙ 10-3 кг – масса олова,
т2 = 13,96 ∙ 10-3 кг – масса тигля,
с1 = 2,46 ∙ 102 Дж/(кг ∙ К) – удельная теплоемкость олова,
с1/ = 2,26 ∙ 102 Дж/(кг ∙ К) — удельная теплоемкость жидкого олова,
с2 = 8,3 ∙ 102 Дж/(кг ∙ К) – удельная теплоемкость тигля.
7. Подставляя данные в выражение (2.27), вычисляют ΔS – приращение энтропии.
8. Вычисляют погрешность методом косвенных измерений
![]()
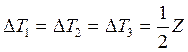 ,
,
где Ζ – цена деления термометра.
2.2.4 Контрольные вопросы
1. Что называется плавлением, кристаллизацией?
2. Что понимают под удельной теплотой плавления?
3. Имеет ли смысл говорить об удельной теплоте плавления аморфных тел?
4. Как в данной работе определяют температуру плавления?
5. Что называется энтропией?
6. Как изменяется энтропия в процессе кристаллизации олова?
2.3 ЛАБОРАТОРНАЯ РАБОТА №4. ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ГАЗА МЕТОДОМ АДИАБАТИЧЕСКОГО РАСШИРЕНИЯ
Цель работы: Определить коэффициент Пуассона для воздуха.
Задание: Проработать материал теоретической части, выполнить опыты экспериментальной части, оформить отчет, ответить на контрольные вопросы, защитить работу.
Оборудование и материалы: Закрытый стеклянный баллон, жидкий манометр, насос.
2.3.1 Описание установки

Экспериментальная установка состоит из стеклянного баллона -1, (рис.6.), соединенного с манометром – 2 и насосом. Посредством крана -3, баллон может быть соединен с атмосферой.
2.3.2 Теоретическое обоснование метода
Для определения коэффициента Пуассона γ используют метод адиабатического расширения.
Если при помощи насоса в баллон накачать некоторое количество воздуха, то давление и температура воздуха внутри баллона повысятся. Вследствие теплообмена воздуха с окружающей средой через некоторое время температура, находящегося в баллоне сравняется с температурой внешней среды t1 . Давление, установившееся в баллоне:
![]() ,
,
где H – атмосферное давление,
h1 – добавочное давление, измеряемое разностью уровней жидкости в манометре.
Таким образом, состояние воздуха внутри баллона характеризуется параметрами:
p1, V1, T1 — первое состояние.
Если открыть на некоторое время кран 3, то воздух в баллоне будет расширяться. Давление с сосуде установиться равным атмосферному H, температура понизиться до T2, а объем будет равен V2.
H, T2, V2. – второе состояние.
Применяя уравнение адиабаты к первому и второму состоянию, получим:
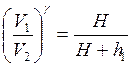 (2.28)
(2.28)
Охладившийся при расширении воздух в баллоне через некоторое время в следствие теплообмена нагревается до температуры внешней среды T1: давление возрастает до некоторой величины:
![]() ,
,
где h2 – новая разность уровней в манометре. Объем воздуха не измениться и будет равен V2.
Третье состояние характеризуется параметрами:
![]() , V2 и T1 – третье состояние.
, V2 и T1 – третье состояние.
Так как в первом и третьем состояниях воздух имеет одну и ту же температуру (процесс изотермический), то применим закон Бойля – Мариотта. (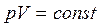 )
)
![]() ,
, 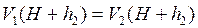 ,
,
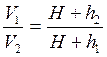 (2.29)
(2.29)
Возведя обе части уравнения (2.29) в степень γ, получим:
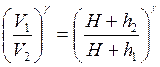 (2.30)
(2.30)
Сравнивая выражения (2.28) и (2.30), получаем:
Логарифмируя последнее выражение и решая относительно γ, находим:
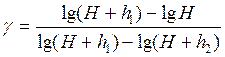
Так как давление H, H+h1 и H+h2 мало отличаются друг от друга, то разности логарифмов можно принять пропорциональными разностям самих давлений и приближенно принять:
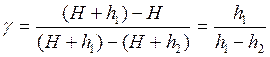 (2.31)
(2.31)
2.3.3 Порядок выполнения работы
1. При открытом кране – 3 насосом накачивают немного воздуха, пока разность уровней жидкости в манометре не достигнет 200 – 300 мм. При накачивании воздух, сжимаемый под поршнем насоса нагревается, следовательно необходимо выждать 1 – 2 минуты, пока, благодаря теплообмену, температура в баллоне станет равной комнатной. После этого измеряют манометром избыточное давление воздуха h1 (в мм ртутного столба).
2. Открывают кран и в тот момент, когда уровни жидкости в обеих коленах манометра сравняются, быстро закрывают кран. Выждав 1 – 2 минуты пока газ, охлажденный при адиабатическом расширении, нагреется до комнатной температуры, измеряют избыточное давление h2. Следует помнить, что h2 и h1 отчитываются как разность высот жидкости в обеих коленах манометра.
3. Опыт повторяют 5 – 7 раз.
4. Данные опыта заносят в таблицу 4.
Таблица 4 — Определение показателя адиабаты воздуха
|
№ |
h1 (мм) |
h2 (мм) |
γ |
γср |
Δ γ |
5. Подставляя в формулу (2.31) значения h2 и h1, взятые из каждого опыта, вычисляют γ.
6. Вычисляют погрешность методом прямых измерений. Ответ представляют в виде: γ = γср ± Δ γ.
2.3.4 Контрольные вопросы
1. Что называется удельной теплоемкостью вещества?
2. Почему удельная теплоемкость газа зависит от способов и условии нагревания?
3. Почему удельная теплоемкость газа при постоянном давлении больше удельной теплоемкости при постоянном объеме?
4. Какой процесс называется адиабатическим?
5. Что происходит с внутренней энергией при адиабатическом процессе?
6. Как изменяется температура при адиабатическом процессе?
7. Почему в данной установке манометр наполняют водой, а не ртутью?
3 КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
Закон Максвелла для распределения молекул идеального газа по скоростям.
Для того, чтобы можно было количественно описать распределение молекул по значениям скорости, возьмем в воображаемом пространстве прямоугольные координатные оси, по которым будем откладывать значения υх, υу, υz отдельных молекул. Тогда скорости каждой молекулы будет соответствовать точка в этом пространстве. Из – за столкновений положения точек будут непрерывно меняться, но их плотность в каждом месте будет const в случае равновесного состояния газа. Тогда количество молекул, компоненты скоростей которых лежат в пределах от υх до υх + d υх, от υу до υу + d υу, от υz до υz + d υz, можно представить в виде:
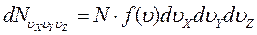 (3.1)
(3.1)
где ![]() — плотность точек в пространстве,
— плотность точек в пространстве,
N – полное число молекул в данной массе газа,
![]() — количество молекул, компоненты скоростей которых лежат в пределах от υх до υх + d υх, от υу до υу + d υу, от υz до υz + d υz.
— количество молекул, компоненты скоростей которых лежат в пределах от υх до υх + d υх, от υу до υу + d υу, от υz до υz + d υz.
Если объем области 4∙πυ2 d υ, то число точек, находящихся в этой области определяется выражением:
![]() ,
,
это выражение дает число молекул, величина скоростей которых лежит в интервале от υ до υ + d υ.
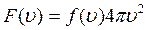 (3.2)
(3.2)
— есть функция распределения молекул газа по скоростям.
Решением этой функции является функция вида:
 (3.3)
(3.3)
Постоянная А определяется из условия нормировки, отсюда имеем функцию распределения:
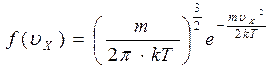 (3.4)
(3.4)
Согласно выражению (3.4) имеем:
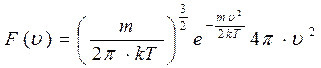 , (3.5)
, (3.5)
где k — постоянная Больцмана,
т — масса молекулы,
υ – скорость молекулы,
Т – абсолютная температура.
Характерным для этой функции является то, что в показателе экспоненты стоит, взятое со знаком минус отношение кинетической энергии молекул, отвечающее рассматриваемой скорости к kT, т. е. величине, характеризующей среднюю энергию молекул газа.
График функции (3.3) дан на рисунке 7. Он совпадает с гаусовской кривой распределения случайной величины. График функции (3.4) дан на рисунке 8.

 Поскольку при возрастании υ множитель вида
Поскольку при возрастании υ множитель вида ![]() убывает быстрее, чем растет множитель υ2, функция начинаясь в нуле (из – за υ2 ) достигает максимума и затем асимптотически стремиться к нулю. Площадь, охватываемая кривой равна единице.
убывает быстрее, чем растет множитель υ2, функция начинаясь в нуле (из – за υ2 ) достигает максимума и затем асимптотически стремиться к нулю. Площадь, охватываемая кривой равна единице.
Распределение молекул по скоростям выглядит так как на рисунке 9.
Из функции (3.2) найдем среднюю скорость молекул <υ>:
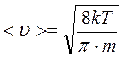
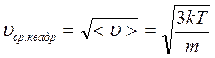
![]()
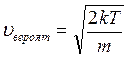
Из графика на рисунке 10 видно, что скорость молекул зависит от температуры. Экспериментально этот закон Максвелла проверил Штерн (1920 г.).
Для молекул, находящихся в силовом поле, можно найти зависимость концентрации молекул воздуха от высоты подъема над поверхностью Земли:
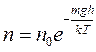
и зависимость давления от высоты:
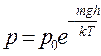 (3.6)
(3.6)
при этом используется распределение Больцмана.
При хаотическом движении молекул газа они сталкиваются друг с другом и со стенками сосуда. Значит есть необходимость введения таких параметров газа как число соударений, длина свободного пробега, эффективного диаметра молекул.
Между двумя столкновениями молекула проходит определенное расстояние λ – длину свободного пробега:
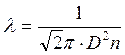
где n – концентрация молекул в среднем объеме,
D – эффективный диаметр молекул, т. е. расстояние на которое подходят друг к другу соударяющиеся молекулы (если их считать твердыми упругими шарами).
D – статистическая величина, характеризующая вероятность процесса соударений молекул металла с молекулами воздуха.
Диаметр эффективного сечения зависит от температуры и относительной скорости молекул.
Молекулярно – кинетическая теория позволила получить формулы связывающие макроскопические параметры газа (давление, температура, объем) с его микроскопическими параметрами (размеры молекул, их масса, скорость, средняя длина свободного пробега, эффективный диаметр молекул).
Пользуясь этими формулами можно на основе измеренных макроскопических параметров газа, найти его микроскопические параметры.
Барометрическая формула.
При выводе основного уравнения кинетической теории газов и закона Максвелла предполагается, что на молекулы газа не действуют никакие внешние силы. Фактически молекулы любого газа всегда находятся в поле тяготения Земли и, если бы не было теплового движения молекул воздуха, то они все бы упали на Землю. Тяготение и тепловое движение приводят газ в состояние, при котором его концентрация убывает с высотой. Известно, что давление газа при данной температуре Т пропорционально числу частиц в единице объема:
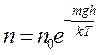
Откуда закон убывания давления р с высотой h будет тот же, что и закон убывания числа частиц:
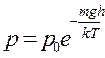
это и есть барометрическая формула, которая указывает, что давление газа убывает с высотой экспоненциально. Формулой (3.6) можно приближенно пользоваться для определения атмосферного давления на разных высотах при условии, что Т = const.
Явления переноса в газах.
Беспорядочность теплового движения молекул газа, непрерывное соударение между ними приводят к постоянному перемешиванию частиц и изменению их скоростей и энергий.
Если в газе существует пространственная неоднородность плотности, температуры или скорости упорядоченного перемешивания отдельных слоев газа, то движение молекул выравнивает эти неоднородности. При этом в газе появляются процессы, называемые явлениями переноса: теплопроводность, вязкость, диффузия.
Теплопроводность имеет место тогда, когда в газе существует разность температур, вызванная какими – либо внешними причинами. Молекулы газа в разных местах его объема имеют разные средние кинетические энергии. Поэтому при хаотическом тепловом движении молекул происходит направленный перенос энергии.
Явление внутреннего трения (вязкости) связанно с возникновением сил трения между слоями газа или жидкости, перемещающимися параллельно друг другу с различными по величине скоростями. Внутреннее трение или вязкость – направленный перенос количества движения, связанный с выравниванием скорости упорядоченного движения отдельных слоев.
Третье явление переноса – диффузия заключается в самопроизвольном взаимном проникновении и перемешивании двух соприкасающихся газов, жидкостей и даже твердых тел. Диффузия – направленный перенос массы из мест с большей концентрацией в места с меньшей концентрацией.
Закономерности и коэффициенты явлений переноса:
Экспериментально установлено, что перенос массы в веществе при явлении диффузии подчиняется закону А. Фика: масса газа, которая переноситься за единицу времени через взятый внутри газа элемент поверхности, площадь которого равна единице, прямо пропорциональна скорости изменения плотности газа в направлении нормали Х к рассматриваемой площадке:
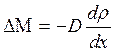 (3.7)
(3.7)
Величина ![]() , характеризующая изменение плотности на единицу длины в направлении Х, называется градиентом плотности. D – коэффициент диффузии равен:
, характеризующая изменение плотности на единицу длины в направлении Х, называется градиентом плотности. D – коэффициент диффузии равен:
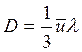
Явление внутреннего трения, как показывает опыт, подчиняется закону Ньютона:
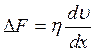 (3.8)
(3.8)
где ![]() — изменение скорости движения слоев жидкости на единицу длины в направлении Х, перпендикулярном поверхности слоя.
— изменение скорости движения слоев жидкости на единицу длины в направлении Х, перпендикулярном поверхности слоя.
Знак «-» показывает, что сила внутреннего трения направлена в сторону, противоположную направлению скорости движения газа или жидкости.
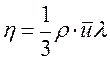 ,
,
где η – коэффициент вязкости.
Явление теплопроводности возникает, если различные слои газа имеют разную температуру, т. е. обладают различной внутренней энергией. Процесс передачи внутренней энергии в форме теплоты происходит так, что количество тепла ΔQ, переносимое за единицу времени через единичную площадку, прямо пропорционально скорости изменения температуры в направлении нормали к этой площадке, т. е.
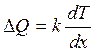 (3.9)
(3.9)
Эта формула Фурье, называемая законом теплопроводности Фурье, где k – коэффициент теплопроводности.
Знак «–» показывает, что энергия переместится в сторону убывания температуры.
Коэффициент теплопроводности показывает, какое количество теплоты переноситься через единицу площади за единицу времени, при градиенте температуры равном единице:
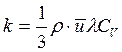
Коэффициенты теплопроводности и вязкости не зависят от давления, потому что с увеличением давления увеличивается плотность, но уменьшается λ, а коэффициенты η и k остаются постоянными. Таким образом закон Фика, закон Ньютона и Закон Фурье являются дифференциальными законами, справедливыми для малой площадки – dS и малого промежутка времени – dτ .
Поэтому их можно записать в таком виде:
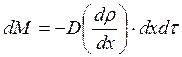 (3.10)
(3.10)
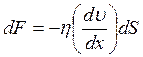 (3.11)
(3.11)
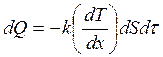 (3.12)
(3.12)
Эти формулы совпадают с написанными выше, если под ΔМ, ΔF, ΔQ понимать следующие выражения:
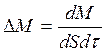 ,
, 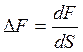 ,
, 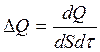 .
.
Различные слои жидкости при ее движении имеют различные скорости, между этими слоями действуют силы внутреннего трения или вязкость. Как известно, сила внутреннего трения F пропорциональна величине площади сопротивления движущихся слоев – dS, градиенту скорости — ![]() , т. е.
, т. е.
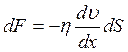 (3.13)
(3.13)
где η – коэффициент вязкости.
3.1 ЛАБОРАТОРНАЯ РАБОТА № 5. ОПРЕДЕЛЕНИЕ СРЕДНЕЙ ДЛИНЫ СВОБОДНОГО ПРОБЕГА И ЭФФЕКТИВНОГО ДИАМЕТРА МОЛЕКУЛ ВОЗДУХА
Цель работы: Экспериментальным путем определить среднюю длину пробега, эффективный диаметр молекул воздуха.
Задание: Проработать материал теоретической части, выполнить опыты экспериментальной части, оформить отчет, ответить на контрольные вопросы, защитить работу.
Оборудование и материалы: Установка на штативе, весы с разновесом, термометр, барометр, мензурка с делениями.
3.1.1 Описание установки
 Экспериментальная установка состоит из: баллона А, крана В, трубки С рисунок 11.
Экспериментальная установка состоит из: баллона А, крана В, трубки С рисунок 11.
3.1.2.Теоретическое обоснование метода
Для нахождения средней длины свободного пробега молекул газа λ используют формулу, выражающую зависимость коэффициента внутреннего трения (вязкости) – η от λ и ![]() :
:
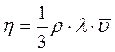 (3.14)
(3.14)
где ρ – плотность газа,
![]() – средняя арифметическая скорость молекул газа.
– средняя арифметическая скорость молекул газа.
Подставляя в формулу (3.14) значения ρ и ![]() из формул:
из формул:
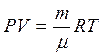 ;
; 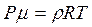 ;
; 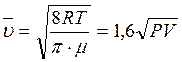 получим:
получим:
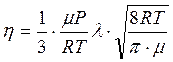 (3.15)
(3.15)
В данной работе используется зависимость коэффициента вязкости от параметров трубки: l и r (см. рис. 11) через которую проходит газ, а также разность давлений, возникшая на концах этой трубки. Эта зависимость выражает формулу Пуазейля:
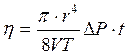 , (3.16)
, (3.16)
где V – объем газа, в данном случае воздуха, проходящего через трубку С, длиной l и радиусом r, за время t, ΔР – разность давлений на концах трубки С.
Из формул (3.15) и (3.16) средняя длина свободного пробега молекул воздуха выразится:
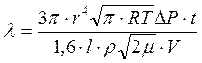 (3.17)
(3.17)
3.1.3 Порядок выполнения работы
1. Наполняют баллон А на ![]() водой и отмечают уровень воды h1. Взвешивают мензурку без воды – т0.
водой и отмечают уровень воды h1. Взвешивают мензурку без воды – т0.
2. Открывают кран В и добившись, чтобы вода из крана вытекала каплями, подставляют мензурку и одновременно включают секундомер.
3. Когда в мензурке будет 50 – 70 миллилитров воды, кран закрывают и останавливают секундомер, отмечают новый уровень воды в баллоне – h2.
4. Взвешивают мензурку с водой т1. Находят массу воды: т = т1– т0.
5. По весу воды в мензурке определяют объем воды. Объем вытекший из баллона воды, будет одновременно объемом воздуха вошедшего в баллон через трубку С.
6. По формуле (3.17) подсчитывают среднюю длину свободного пробега молекул воздуха.
7. Разность давлений ΔР вычисляют по формуле:
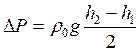 , (3.18)
, (3.18)
где ρ0 – плотность воды при температуре опыта,
h1, h2 – уровни воды в баллоне А.
Опыт повторить 3 – 5 раз.
8. Для подсчета эффективного диаметра молекул воздуха в формуле
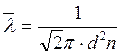 заменяем n выражением
заменяем n выражением 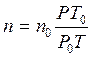 и получим:
и получим:
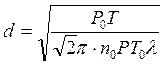 (3.19)
(3.19)
где n0 – число Лошмидта, равное = 2,387∙1025 м-3,
Р0 — давление и Т0 – температура при нормальных условиях:
Р0 = 760 мм. рт. ст. = 105 Па. Т0 = 273 ˚К.
λ — средняя величина с учетом ошибок из 3 – 5 значений λ, вычисляется по формуле (3.16). Р и Т – давление и температура, при которых протекает опыт, берут из показаний термометра и барометра находящихся в лаборатории. Результаты измерений и вычислений заносят в таблицу 5.
Таблица 5 – Определение средней длины свободного пробега и эффективного диаметра молекул воздуха.
|
№ |
t ср (c) |
h1 (м) |
h2 (м) |
ΔР (Па) |
λ (м) |
Δ λ (м) |
d (м) |
Т (˚К) |
Р (Па) |
V (м3) |
9. Специфика установки l = 3,6∙10-2 м, r = 2,2∙10-4 м.
μ = 29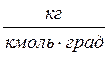 = 29∙10-3
= 29∙10-3 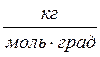 , R = 8,31
, R = 8,31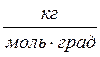 ,
,
Р0 = 1 атм = 760 мм. рт. ст. = 105 Па, ρ0 =103 ![]()
10. Вычислить погрешность измерений методом косвенных измерений:
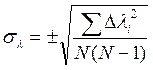 ;
; 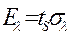 ;
; 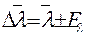 .
.
3.1.4 Контрольные вопросы.
1. Объяснить статистический метод Максвелла распределения молекул по скоростям.
2. Перечислить основные виды скоростей и показать их на кривой распределения.
3. Объяснить физический смысл кривой распределения Максвелла.
4. Дать определение длины свободного пробега и эффективного диаметра молекул.
5. Объяснить метод определения λ и d в данной работе.
3.2 ЛАБОРАТОРНАЯ РАБОТА № 6. ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ВЯЗКОСТИ ЖИДКОСТИ ПО МЕТОДУ СТОКСА
Цель работы: Определить коэффициент вязкости жидкости.
Задание: Проработать материал теоретической части, выполнить опыты экспериментальной части, оформить отчет, ответить на контрольные вопросы, защитить работу.
Оборудование и материалы: Цилиндр с жидкостью, шарики, секундомер, штангенциркуль.
3.2.1 Теоретическое обоснование метода
Рассмотрим свободное падение тела (в нашем случае металлический шарик) в вязкой покоящейся жидкости. На такой шарик, падающий в вязкой жидкости действуют:
а) сила тяжести
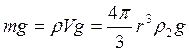 , (3.20)
, (3.20)
где r – радиус шарика,
ρ2 — плотность шарика,
g – ускорение свободного падения,
б) выталкивающая сила (по закону Архимеда):
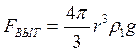 , (3.21)
, (3.21)
где ρ1 – плотность жидкости.
в) сила сопротивления движению, обусловленная силами внутреннего трения между слоями жидкости:
![]() , (3.22)
, (3.22)
где υ – скорость слоев жидкости.
Подчеркиваем, что здесь играет роль не трение шарика с жидкостью, трение отдельных слоев жидкости друг о друга, так как при соприкосновении твердого тела с жидкостью к поверхности тела тотчас же прилипает тонкий слой жидкости. Этот слой перемещается в месте с телом со скоростью движения тела. При движении он увлекает соседние слои жидкости, которые на некоторый период времени приходят в плавное безвихревое движение (если скорости малы и малы размеры шариков).
Равнодействующая сила, действующая на шарик:
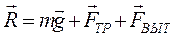 , (3.23)
, (3.23)
Вначале скорость движения шарика будет возрастать, но так как по мере увеличения скорости шарика, сила сопротивления будет тоже возрастать, то наступит момент, когда сила тяжести будет уравновешенна суммой сил FТР и FВЫТ, равнодействующая сила станет равной нулю, т. е.
![]() (3.24)
(3.24)
С этого момента движение шарика становиться равномерным со скоростью υ0.
Подставляя в (3.24) соответствующие значения 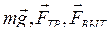 получим:
получим:
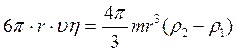
отсюда коэффициент вязкости будет:
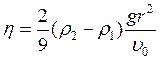 (3.25)
(3.25)
Уравнение (3.25) справедливо, когда шарик падает в безграничной среде. Если же шарик падает вдоль оси трубки с радиусом R , то приходиться учитывать влияние боковых стенок этой трубки, и формула примет вид:
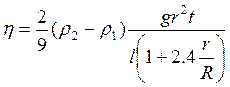 , (3.26)
, (3.26)
где ρ1 = 1,26∙103 кг/м3;![]()
ρ2= 7,8∙103 кг/м3;![]()
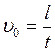 .
.
3.2.2 Порядок выполнения работы
1. Измеряют диаметр и опускают шарик в жидкость, как можно ближе к оси цилиндра. Глаз наблюдателя должен быть установлен против верхней метки. В момент прохождения шариком верхней метки «а» пускают в ход секундомер, в момент прохождения нижней метки «б» — секундомер останавливают. Отсчет по секундомеру дает время прохождения шариком пути, между метками «а» и «б» (до «а» не менее 20 – 30 см).
2. Масштабной линейкой измеряют расстояние между метками «а» и «б» на цилиндре, проходимое шариком.
3. Полученные результаты заносят в таблицу 6.
Таблица 6 – Определение коэффициента вязкости глицерина
|
№ |
r (м) |
R (м) |
t (с) |
l (м) |
η |
Δ η |
4. Измерения проводят 5 раз. По формуле (3.26) определяют коэффициент вязкости.
5. По формуле Стокса 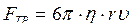 измеряют силу внутреннего трения – FТР.
измеряют силу внутреннего трения – FТР.
3.2.3 Контрольные вопросы
1. Какое явление переноса изучается в данной работе?
2. Показать на графике, какие силы действуют на шарик в жидкости?
3. Почему метка, от которой начинают отсчет времени и пути, пройденного шариком в жидкости, должна находиться ниже поверхности жидкости?
4. Измениться ли значение η, если вместо остального использовать свинцовый шарик?
5. При входе шарика в жидкость к его поверхности прилипает пузырек воздуха. Влияет ли он на результаты измерений? Как предотвратить образование пузырьков?
3.3 ЛАБОРАТОРНАЯ РАБОТА № 7. ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ
Цель работы: Определение коэффициента теплопроводности твердых тел.
Задание: Проработать материал теоретической части, выполнить опыты экспериментальной части, оформить отчет, ответить на контрольные вопросы, защитить работу.
Оборудование и материалы: Установка для определения коэффициента теплопроводности, нагревательная печь, термометр, штангенциркуль, секундомер, набор твердых тел.
3.3.1 Теоретическое обоснование метода
Используя теорию переноса, в частности теплоты, можно калометрически определить коэффициент теплопроводности. Так как количество теплоты, отданное телом (дерево, асбест), равно количеству теплоты принятое водой в калориметре, запишем:
![]() (3.27)
(3.27)
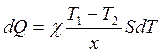 (3.28)
(3.28)
Решив совместно уравнения (3.27) и (3.28), получим формулу для коэффициента теплопроводности
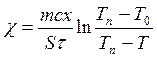
Или с учетом теплоемкости сосуда, имеем:
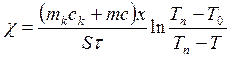
Введя константу, учитывающую теплоемкость сосуда, имеем:
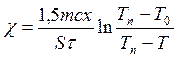 , (2.29)
, (2.29)
где S = πd2/4 – площадь исследуемого вещества,
Т0 – температура воды в сосуде Д до нагрева,
Т – температура воды в сосуде Д через время τ,
х – толщина слоя вещества,
т – масса воды,
Тп = 100 °С – температура пара,
с = 4190 Дж/(кг К) – теплоемкость воды.
3.3.2 Описание установки
Вид установки изображен на рисунке 12. Пар из кипятильника К непрерывно поступает в сосуд С, благодаря чему температура стенок сосуда остается постоянной, равной 100 °С. На верхнюю крышку сосуда С кладется диск из исследуемого вещества О (дерево, асбест). Сверху устанавливается сосуд Д с водой. Изменение температуры фиксируется термометром Т. Для равномерного прогрева воду все время помешивают мешалкой М.
Т М

Д
![]()
 О К
О К


![]() С
С

Рисунок 12 – Экспериментальная установка
3.3.3 Порядок выполнения работы
1. С помощью мензурки в сосуд наливают определенную массу воды.
2. Измеряют штангенциркулем толщину – х и диаметр каждого образца d и определяют площадь S.
3. Устанавливают образец на сосуд С, сверху ставят сосуд Д с водой и калориметр плотно закрывают крышкой.
4. Включают электроплитку когда из отводной трубки сосуда К начинает идти пар, засекают время и измеряют температуру Т0.
5. Через τ = 20 минут записывают температуру Т (при этом не забывают помешивать воду в сосуде Д).
6. По формуле (2.29) вычисляют коэффициент теплопроводности.
7. Результаты измерений заносят в таблицу 7.
Таблица 7 – Определение коэффициента теплопроводности
|
№ |
х (м) |
Т (К) |
τ (с) |
d (м) |
m (кг) |
χ |
Δ χ |
3.3.4 Контрольные вопросы
1. Какие признаки, связанные с молекулярным движением, переносятся в процессе теплопроводности, диффузии, вязкости?
2. Чем отличается механизм переноса в твердых телах от механизма переноса в газах?
3. В каких единицах измеряется коэффициент теплопроводности?
4. Объяснить от каких параметров зависит коэффициент теплопроводности?
5. Как учитывается коэффициент теплопроводности в технике и строительстве?
СПИСОК ЛИТЕРАТУРЫ
1. Детлаф А. А, Яворский Б. М Курс физики М.: Академия. 2003, 2009 – 720 с.
2. Савельев И. В. Курс общей физики т.1 М.: Высшая школа, 1982. – 432 с.
3. Трофимова Т. И. Курс физики М.: Высшая школа, 2001, 2007, 2008. – 560 с.
4. Сивухин Л. В. Общий курс физики т.2 М.: Наука 1986. – 300 с.
5. Матвеев А. Н. Молекулярная физика т.2 М.: Наука, 1981. – 400 с.
6. МР к проведению вводного практикума по дисциплине «Физика» для студентов технических специальностей. Коновалов В. М. Улжагулова Г. А. РИИ г. Рудный 2007. – 12 с.
ПРИЛОЖЕНИЕ А
(обязательное)
Образец оформления титульного листа
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РЕСПУБЛИКИ КАЗАХСТАН
Рудненский индустриальный институт
Кафедра безопасности жизнедеятельности и промышленной экологии
Лабораторная работа
тема__________________________________
Дисциплина «Физика»
Преподаватель
________________________
(ученая степень, ученое звание)
________________________
(личная подпись, И. О.Ф.)
«___»______________20__г.
Студент
________________________
(личная подпись, И. О.Ф.)
Группа__________________
№ зачетной книжки_______
«__»_______________20__г.
Рудный 20__
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РЕСПУБЛИКИ КАЗАХСТАН
Рудненский индустриальный институт
РАССМОТРЕНО
На заседании кафедры БЖ и ПЭ
Пр. № от
Зав. кафедрой Г. Г. Куликова
ОДОБРЕНО
На заседании МК ЭМФ
Пр. № от
Председатель МКФ О. В. Вуейкова
ОДОБРЕНО
На заседании МК ГСФ
Пр. № от
Председатель МКФ Ю. П. Лазебная
ОДОБРЕНО
На заседании МК ФЭиИС
Пр. № от
Председатель МКФ Н. Ю. Саргаева
УТВЕРЖДЕНО И РЕКОМЕНДОВАННО к изданию
На заседании УМС
Пр. № от
Председатель УМС Б. А. Жаутиков
Кафедра безопасности жизнедеятельности и промышленной экологии
З. С. Ерсултанова
Методические указания по выполнению
лабораторных работ
по дисциплине «Физика»
раздел «Молекулярная физика»
для студентов технических специальностей
Рудный 2010
Св. план 2010 – 2011 уч. год.
Ерсултанова Зейнеп Сапаргалиевна
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
по дисциплине «Физика»
раздел «Молекулярная физика»
(для студентов технических специальности)
Подписано в печать
Тираж экз. Формат 21х30/2. Бумага листовая для ксероксной техники.
Печать Riso. Объем уч.-изд. л. Заказ №
Издательство Рудненского индустриального института
Редакционно-издательский центр РИИ
г. Рудный, ул. 50 лет Октября, 58


