Понятие пробега химической реакции
где 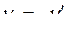 и
и 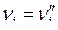 , т. е. стехиометрические коэффициенты левой части уравнения ХР считаются отрицательными, т. к. они убывают в ходе прямой ХР, а коэффициенты правой части уравнения ХР считаются положительными. В этой форме записи уравнение ХР может быть представлена в виде:
, т. е. стехиометрические коэффициенты левой части уравнения ХР считаются отрицательными, т. к. они убывают в ходе прямой ХР, а коэффициенты правой части уравнения ХР считаются положительными. В этой форме записи уравнение ХР может быть представлена в виде:
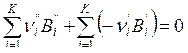
Например, для ХР сгорания водорода:
2Н2 + О2=2Н2О,
имеем для первой формы записи уравнения ХР:
![]()
и для второй формы записи уравнения ХР:
2Н2О – 2Н2 – О2 =0
имеем: 
При подсчете чисел молей принято не принимать во внимание жидкие и твердые тела.
Например, для ХР:
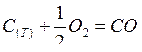 , имеем
, имеем 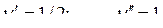 .
.
8.2. Понятие пробега химической реакции
При химических реакциях изменения количеств реагирующих компонентов пропорциональны их стехиометрическим коэффициентам:
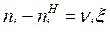 ,
,
где ni – текущее значение количества вещества i-го компонента при протекании ХР; ![]() — количество вещества i-го реагента в начальный момент ХР;
— количество вещества i-го реагента в начальный момент ХР; ![]() — пробег химической реакции.
— пробег химической реакции.
Величина пробега ХР ![]() характеризует степень изменения состава термодинамической системы при химической реакции и показывает на сколько сдвинулась химическая реакция по отношению к начальному состоянию системы.
характеризует степень изменения состава термодинамической системы при химической реакции и показывает на сколько сдвинулась химическая реакция по отношению к начальному состоянию системы.
В начальный момент химической реакции принимается, что ![]() =0.
=0.
Рассмотрим термодинамическую систему, в которой протекает лишь одна ХР. В реакции могут участвовать не все вещества, входящие в рабочее тело. Однако присутствие веществ, не участвующих в химической реакции, влияет на ход ее протекания.
Текущее число молей i-го вещества равно 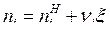 , где i=1, 2, …КС – число веществ в системе. Для веществ левой части уравнения ХР:
, где i=1, 2, …КС – число веществ в системе. Для веществ левой части уравнения ХР: ![]() , и для веществ правой части уравнения ХР:
, и для веществ правой части уравнения ХР: 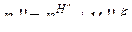 .
.
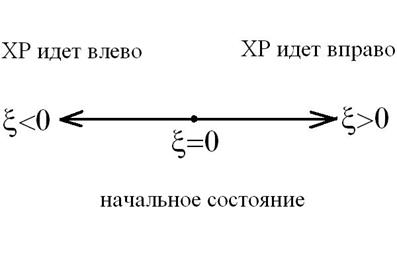
Стехиометрический коэффициент i-го компонента vi показывает, на сколько должно измениться число молей этого компонента при ХР. Если ХР идет вправо, т. е. пробег ХР ![]() >0, то исходные вещества убывают, а продукты реакции увеличиваются. Если ХР идет влево, т. е. пробег ХР
>0, то исходные вещества убывают, а продукты реакции увеличиваются. Если ХР идет влево, т. е. пробег ХР ![]() <0, то продукты реакции убывают, а количество исходных веществ увеличивается, как это показано на схеме:
<0, то продукты реакции убывают, а количество исходных веществ увеличивается, как это показано на схеме:
Стехиометрические коэффициенты ![]() — безразмерные величины. Пробег химической реакции
— безразмерные величины. Пробег химической реакции ![]() имеет размерность – [моль].
имеет размерность – [моль].
С физической точки зрения пробег химической реакции – это число элементарных реакций, измеряемое числами молей. Если химическая реакция прошла путь от ![]() =0 до
=0 до ![]() =1 , то это означает, что произошло число элементарных реакций, равное числу Авагадро NA=6,022·1023. В общем случае число элементарных реакций равно произведению числа Авагадро на пробег ХР, т. е. произведению NA·
=1 , то это означает, что произошло число элементарных реакций, равное числу Авагадро NA=6,022·1023. В общем случае число элементарных реакций равно произведению числа Авагадро на пробег ХР, т. е. произведению NA·![]() .
.
Изменение количеств реагирующих веществ в процессе ХР при пути ХР от ![]() =0 до
=0 до ![]() =1 можно проиллюстрировать следующей таблицей:
=1 можно проиллюстрировать следующей таблицей:
|
Исходные вещества |
Продукты реакции |
|
|
|
Начальный момент ХР |
|
|
0 |
|
Конечный момент ХР |
|
|
1 |
8.3. Изохорный и изобарный тепловые эффекты химических реакций и связь между ними
Тепловой эффект химической реакции (ТЭХР) рассматривается только для закрытых ТС 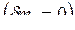 при отсутствии работ
при отсутствии работ ![]() и при фиксации двух параметров: T,V=const и T,p=const. При этих условиях мы фактически задаем состояние ТС, если система является равновесной.
и при фиксации двух параметров: T,V=const и T,p=const. При этих условиях мы фактически задаем состояние ТС, если система является равновесной.
Для простой, закрытой ТС уравнение 1-го закона термодинамики имеет вид:
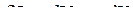 , при Т,V=const:
, при Т,V=const: 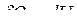 , (1)
, (1)
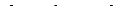 , при Т, р=const:
, при Т, р=const:  . (2)
. (2)
Тепловой эффект ХР – это максимальная теплота процесса, выделяемая или поглощаемая ТС при T,V=const и Т, р=const и отнесенная к пробегу ХР, т. е.:
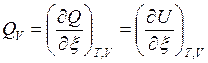 , [Дж/моль], (3)
, [Дж/моль], (3)
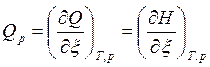 , [Дж/моль], (4)
, [Дж/моль], (4)
где QV – изохорный тепловой эффект ХР; Qp — изобарный тепловой эффект ХР; ![]() — пробег ХР. QV и Qp – функции состояния, т. е. они характеризуют термодинамическое состояние химически реагирующей ТС.
— пробег ХР. QV и Qp – функции состояния, т. е. они характеризуют термодинамическое состояние химически реагирующей ТС.
Таким образом, изохорный QV и изобарный Qp ТЭХР выражаются через изменение внутренней энергии и энтальпии соответственно и определяются только начальными и конечными состояниями ТС.
Тепловые эффекты ХР не зависят от промежуточных химических состояний, через которые проходит ТС (закон Гесса, 1840г.).
В соответствии с законом Гесса сумма тепловых эффектов промежуточных ХР есть величина постоянная, равная тепловому эффекту сложной реакции независимо от последовательности протекания реакций. Закон Гесса позволяет косвенным путем аналитически вычислить тепловые эффекты ХР, в том числе и таких, которые не поддаются эксперименту.
Для ТС, где протекает одна химическая реакция, внутренняя энергия и энтальпия определяются выражениями:
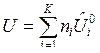 , (5)
, (5)
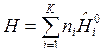 , (6)
, (6)
где 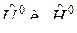 , Дж/моль, молярные величины внутренней энергии и энтальпии i-го вещества при стандартном состоянии (р0=1 физ. атм);
, Дж/моль, молярные величины внутренней энергии и энтальпии i-го вещества при стандартном состоянии (р0=1 физ. атм); 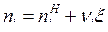 , моль, количество i-го вещества.
, моль, количество i-го вещества.
Соотношения (5) и (6) справедливы как для идеальных, так и для реальных газов и растворов. Для идеальных термодинамических систем величины 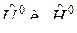 являются функциями только температуры. Тогда получим связи:
являются функциями только температуры. Тогда получим связи:
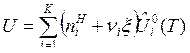 , (7)
, (7)
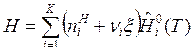 . (8)
. (8)
После подстановки выражений (7) и (8) в формулы (3) и (4) и дифференцирования по пробегу ХР![]() получим формулы для расчета изохорного и изобарного ТЭХР:
получим формулы для расчета изохорного и изобарного ТЭХР:
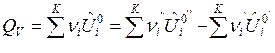 , Дж/моль, (9)
, Дж/моль, (9)
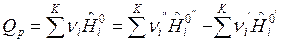 , Дж/моль (10)
, Дж/моль (10)
По формулам (9) и (10) определяется тепловой эффект образования вещества. Тепловой эффект сгорания (теплота сгорания) равен теплоте образования с обратным знаком:
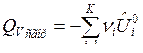 , (11)
, (11)
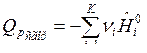 . (12)
. (12)
Рассмотрим пример: для ХР: 2Н2О-2Н2-О2=0. Изобарный ТЭХР равен: ![]() , Дж/моль, т. е. из двух молекул Н2 и одной молекулы О2 образуется две молекулы воды. Если число элементарных реакций равно NA=6,022·1023, то суммарная теплота этих реакций является тепловым эффектом. Таким образом, моль – это набор из пяти частиц (2Н2, О2, 2Н2О) умноженный на число Авагадро.
, Дж/моль, т. е. из двух молекул Н2 и одной молекулы О2 образуется две молекулы воды. Если число элементарных реакций равно NA=6,022·1023, то суммарная теплота этих реакций является тепловым эффектом. Таким образом, моль – это набор из пяти частиц (2Н2, О2, 2Н2О) умноженный на число Авагадро.
Если 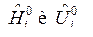 зависят и от температуры и от состава ТС, то получим выражения:
зависят и от температуры и от состава ТС, то получим выражения:
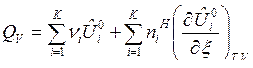 , (13)
, (13)
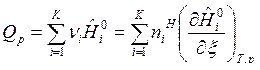 . (14)
. (14)
Связь между изобарным и изохорным ТЭХР получим следующим образом. Запишем для 1 моля идеального газа выражение для энтальпии:
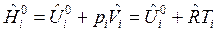 .
.
Тогда для смеси идеальных газов имеем:
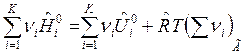 , (15)
, (15)
где 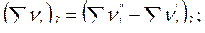
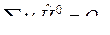 ;
; 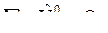 .
.
После подстановки Qp и QV в выражение (15) имеем:
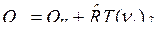 . (16)
. (16)
Эта связь между Qp и QV для смеси идеальных газов получена, пренебрегая объемами жидких и твердых реагентов.
Зависимость ![]() определяется видом ХР:
определяется видом ХР:
— если ![]() то Qp > QV
то Qp > QV
— если ![]() то Qp = QV
то Qp = QV
— если ![]() то Qp < QV.
то Qp < QV.
Для конденсированных веществ (растворов) 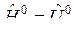 .
.
8.4. Зависимости тепловых эффектов ХР от температуры. Формула Кирхгофа.
Взяв производные от изобарного и изохорного тепловых эффектов ХР по температуре получим формулы Кирхгофа, дающие зависимости тепловых эффектов от температуры:
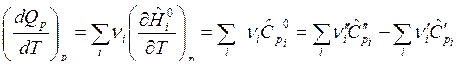 ,
,
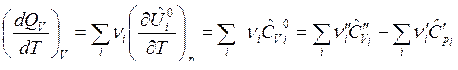 .
.
Производные ![]() и
и 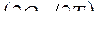 называются температурными коэффициентами тепловых эффектов химической реакции.
называются температурными коэффициентами тепловых эффектов химической реакции.
Температурный коэффициент теплового эффекта ХР равен суммарной молярной теплоемкости конечных веществ (продуктов реакции) без суммарной молярной теплоемкости начальных (исходных) веществ, участвующих в химической реакции.


