Способы задания состава смеси. закон амага.
Уравнения состояния могут быть получены для реального газа, рассматривая взаимодействие частиц. Эти уравнения называются вириальными уравнениями состояния, которые в V – форме имеют вид:
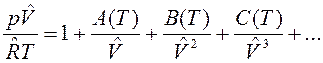 ,
,
где А(Т), В(Т), С(Т) – первый, второй и третий вириальные коэффициенты, зависящие от температуры. В р-форме вириальное уравнение имеет вид:
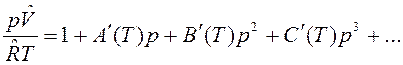
Коэффициенты А(Т), В(Т), С(Т) связаны с коэффициентами А´(Т), В´(Т), С´(Т).
Первый коэффициент А(Т) определяется парными столкновениями частиц, второй коэффициент В(Т) – тройными столкновениями частиц и т. д. Одновременное столкновение большого числа частиц – маловероятно. Наибольшую роль играют парные столкновения частиц. При их учете в правой части вириального уравнения сохраняются только два слагаемых. Примером такого уравнения является уравнение Ван-дер-Ваальса. Коэффициент А(Т) определяется путем интегрирования потенциала парного столкновения. Чем выше давление, тем большее число слагаемых в правой части вириального уравнения следует учитывать.
Термические уравнения состояния для различных веществ устанавливаются также по опытным данным для сжимаемости Z=p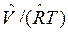 , для теплоемкости С=f(p,T) и для температурного эффекта дросселирования. Надо иметь в виду, что использование уравнения состояния для идеальных газов дает приближенные результаты, справедливые для реальных газов, обладающих малой плотностью, т. е. при небольших давлениях и больших температурах.
, для теплоемкости С=f(p,T) и для температурного эффекта дросселирования. Надо иметь в виду, что использование уравнения состояния для идеальных газов дает приближенные результаты, справедливые для реальных газов, обладающих малой плотностью, т. е. при небольших давлениях и больших температурах.
ГЛАВА 3. СМЕСИ ВЕЩЕСТВ
3.1. Способы задания состава смеси. Закон Амага.
Для проведения термодинамических расчетов систем с газовыми смесями или растворами необходимо знать их состав. Состав смеси может быть задан:
— массовыми долями 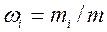 , где
, где 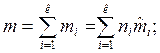
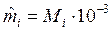 — молярная масса i-го компонента, кг/моль; Mi – относительная молекулярная масса i-го компонента; ni – количество i-го вещества, моль;
— молярная масса i-го компонента, кг/моль; Mi – относительная молекулярная масса i-го компонента; ni – количество i-го вещества, моль;
для каждой фазы 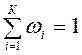 ;
;
— молярными долями 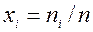 , где
, где 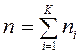 — количество вещества смеси, моль; для каждой фазы сумма молярных долей компонентов смеси
— количество вещества смеси, моль; для каждой фазы сумма молярных долей компонентов смеси 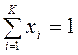 ;
;
— объемными долями, которые равны молярным долям 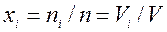 , где
, где 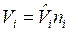 — объем i-го компонента смеси, который при температуре и давлении смеси газов называется приведенным объемом;
— объем i-го компонента смеси, который при температуре и давлении смеси газов называется приведенным объемом; 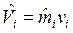 , м3/моль – молярный объем i-го компонента смеси. В соответствии с законом Авагадро молярные объемы всех компонентов смеси газов равны и
, м3/моль – молярный объем i-го компонента смеси. В соответствии с законом Авагадро молярные объемы всех компонентов смеси газов равны и 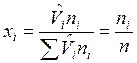 , где
, где 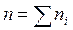 . Сумма приведенных объемов компонентов смеси газов равна объему смеси (закон Амага), т. е.
. Сумма приведенных объемов компонентов смеси газов равна объему смеси (закон Амага), т. е. 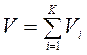 .
.
Состав смеси идеальных газов может быть также задан парциальными давлениями рi, массовыми концентрациями ![]() и молярными концентрациями
и молярными концентрациями 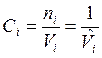 .
.
При задании состава растворов пользуются массовыми и молярными концентрациями.
Парциальное давление рi – это давление i-го компонента газовой смеси при условии, что он занимает весь объем, предназначенный для смеси, при температуре смеси.
3.2. Соотношения для смесей идеальных газов. Закон Дальтона
Средняя молярная масса смеси газов определяется выражением 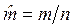 , кг/моль, где
, кг/моль, где 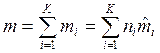 — масса смеси;
— масса смеси; 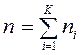 — количество вещества смеси. Тогда
— количество вещества смеси. Тогда
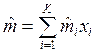 .
.
Удельная газовая постоянная смеси газов
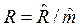 , Дж/(кгК),
, Дж/(кгК),
где 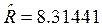 Дж/(мольК) – молярная газовая постоянная;
Дж/(мольК) – молярная газовая постоянная; ![]() — молярная масса смеси.
— молярная масса смеси.
Закон Дальтона:
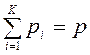 , Па,
, Па,
т. е. сумма парциальных давлений отдельных газов, входящих в смесь, равна полному давлению смеси. Таким образом, каждый газ в сосуде занимает весь объем при температуре смеси, находясь под собственным парциальным давлением.
Уравнение состояния для смеси идеальных газов имеет вид:
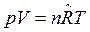 .
.
Для парциального давления и для приведенного объема i-го компонента смеси уравнения состояния имеют вид:
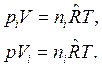
Тогда, разделив эти уравнения почленно первое на второе, имеем
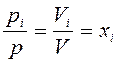 .
.
Разделив уравнение 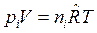 на уравнение
на уравнение 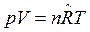 почленно, получим:
почленно, получим:
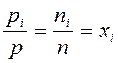 .
.
ГЛАВА 4. ТЕПЛОЕМКОСТЬ
4.1. Виды теплоемкости
Теплоемкость – это свойство тел поглощать и выделять теплоту при изменении температуры на один градус в различных термодинамических процессах. Различают общую среднюю и общую истинную теплоемкости.
Общая средняя теплоемкость термодинамического процесса (ТП) – это теплоемкость тела массой m, кг за конечный отрезок ТП:
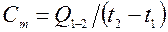 , [Дж/К].
, [Дж/К].
Общая истинная теплоемкость ТП – это теплоемкость тела массой m, кг в каждый данный момент ТП:
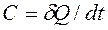 , [Дж/К].
, [Дж/К].
Рассмотрим произвольный ТП 1-2 в координатах ![]() , где Q – подведенная теплота в [Дж]; t – температура в [0C]. Тогда
, где Q – подведенная теплота в [Дж]; t – температура в [0C]. Тогда ![]() ,
, 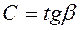 .
.


