Свойства электролитов
9. Вычислите толщину мембраны, если средняя электрическая ёмкость единицы площади мембраны равна 1 мкФ/см2. Диэлектрическая проницаемость биомембраны равна 9.
4. Свойства электролитов
Студент должен знать: элементы физической химии, основы теории Дебая-Хюккеля о равновесных свойствах электролитов; понятия ионной силы раствора, радиуса экранирования заряда, особенности взаимодействия макромолекул в растворах электролитов; основы теории Гуи-Чепмена двойного электрического слоя; методику оценки поверхностной плотности заряда; электрокинетические явления и соотношения между ними, понятие дзета-потенциала и его косвенную оценку по формуле Смолуховского [3, 8].
Контрольные вопросы
1. Ионная сила раствора электролита определяется следующим образом:
а) 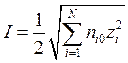 ; б)
; б) 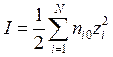 ; в)
; в) 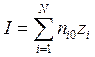 ;
;
г) 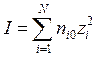 ; д)
; д) 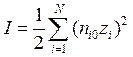 .
.
2. Толщина ионной оболочки, окружающей в электролите заряженную макромолекулу, зависит
а) только от свойств электролита;
б) от температуры и размера макромолекулы;
в) от свойств электролита при определенной температуре;
г) от температуры и ионной силы раствора;
д) от заряда макромолекулы и ионной силы раствора.
3. Объемная плотность заряда ионной атмосферы зависит
а) только от кулоновского поля центрального иона;
б) только от теплового движения;
в) только от свойств электролита;
г) от кулоновского поля центрального иона и теплового движения;
д) от кулоновского поля центрального иона, тепловых флуктуаций и
свойств электролита;
е) от кулоновского поля центрального иона и свойств электролита;
4. Параметра Дебая-Хюккеля χ
а) определяет расстояние 1/χ, на котором происходит падение
потенциала электрического поля центрального иона в е раз;
б) определяет расстояние 1/χ, на котором происходит падение
потенциала электрического поля центрального иона в 2 раза;
в) определяет расстояние χ, на котором происходит падение
потенциала электрического поля центрального иона на порядок;
г) определяет расстояние χ, на котором происходит падение
потенциала электрического поля центрального иона в е раз;
д) правильный ответ не приведен.
5. При разбавлении солевого раствора параметр Дебая-Хюккеля
а) увеличивается; б) не изменяется; в) уменьшается.
6. Белок осаждается в растворе
а) при уменьшении концентрации соли;
б) при высокой ионной силе раствора;
в) при низкой ионной силе раствора;
г) при увеличении концентрации соли.
7. При увеличении ионной силы раствора толщина ионной оболочки
а) уменьшается; б) увеличивается; в) не изменяется.
8. Перечислите и охарактеризуйте электрокинетические явления.
9. Размер диффузионной области двойного слоя зарядов
а) тождествен параметру Дебая-Хюккеля;
б) определяется как расстояние, на котором потенциал электрического поля поверхностного заряда уменьшается в е раз;
в) определяется как расстояние, на котором потенциал электрического поля поверхностного заряда уменьшается на порядок;
г) равен величине, обратной параметру Дебая-Хюккеля;
д) определяется только величиной поверхностного заряда.
10. Распределение ионов в области заряженной поверхности определяется:
а) поверхностным зарядом;
б) тепловыми флуктуациями и свойствами электролита;
в) электростатическим притяжением;
г) электрическим полем поверхностного заряда, тепловыми флуктуациями и свойствами электролита;
д) электрическим притяжением и тепловыми флуктуациями.
Пример решения задачи
Пусть имеется так называемый фосфатный буфер, включающий 0,1 моль/л KH2PO4 и 0,05 моль/л K2HPO4. Оценить ионную силу раствора и дебаевский радиус экранирования заряда (эффективную толщину ионной оболочки) при температуре t=38oC; принять для воды ε=74.
Решение.
Рассчитываем концентрации отдельных ионов:
[K+] = [KH2PO4] + 2[K2HPO4] = 0,2 М (обозначение М эквивалентно размерности моль/л); [H2PO4-] = 0,1 М; [HPO42-] = 0,05 М.
Ионная сила раствора:
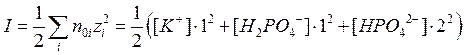 =0,25 М.
=0,25 М.
Дебаевский радиус rD – величина, обратная параметру Дебая-Хюккеля χ:
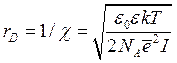 =[8,85·10-12Кл2/(Н·м2)·74·1,38·10-23Дж/К·311К/
=[8,85·10-12Кл2/(Н·м2)·74·1,38·10-23Дж/К·311К/
/(2·6,02·10231/моль·(1,6·10-19) 2Кл2·0,25·103моль/м3)] 1/2 м = 6·10-10 м.
Задачи для самостоятельного решения
1. Концентрации двух растворов одинаковы. В первом присутствуют одновалентные ионы соли NaCl, а во втором – двухвалентные ионы соли CaHPO4. Во сколько раз отличаются радиусы экранирования зарядов в этих растворах, если их диэлектрические проницаемости близки, температуры одинаковы.
2. Физиологический раствор Рингера имеет следующий состав:
[NaCl]=105 мМоль/л (мМ); [KCl]=5 мМ;
[Na2HPO4]=25 мМ; [CaCl2]=2 мМ.
Определить ионную силу I раствора Рингера и толщину ионной атмосферы rD при температуре 25 oC.
3. Рассчитать дебаевские радиусы экранирования заряда для указанных растворов солей заданных концентраций. Найти отношение полученных значений радиусов экранирования.
а) KCl (0,1 г/л) и CaCl2 (10 г/л); б) NaCl (1 г/л) и MgCl2 (0,5 г/л).
5. Транспорт веществ через биологические мембраны
Для решения задач и ответов на вопросы необходимо знание следующего теоретического материала: основ биофизики мембранных процессов, видов и механизмов пассивного и активного транспорта веществ через биомембраны; основных количественных соотношений пассивной диффузии; ионных равновесий – механизмов формирования и соотношений для потенциала Нернста и потенциала Доннана; электродиффузионной теории транспорта ионов через мембраны, уравнение электродиффузии Нернста-Планкаи уравнение Гольдмана для потока ионов; понятия коэффициента распределения, проницаемости, подвижности, ионного канала, транспортной АТФ-азы, трансмембранного потенциала [1, 2, 4, 9-12].
Контрольные вопросы
Обозначения:
-подстрочные индексы «1» и «2» относятся, соответственно, к среде, откуда происходит перенос, и к среде, куда происходит перенос;
— подстрочные индексы «o» и «i» относятся, соответственно, к наружной среде (“outside”) и к внутренней среде (“inside”).
1. Коэффициент проницаемости мембраны описывается следующим выражением:
а) 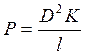 ; б)
; б) 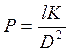 ; в)
; в) 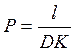 ; г)
; г) 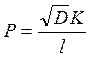 ; д)
; д) 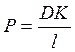 .
.
2. Закон Фика для пассивного транспорта веществ через мембрану имеет вид:
а) 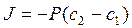 ; б)
; б) 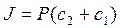 ; в)
; в) 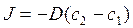 ;
;
г) 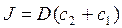 ; д)
; д) 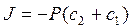 .
.
3. Уравнение Теорелла имеет следующий вид:
а) 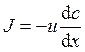 ; б)
; б) 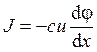 ; в)
; в) 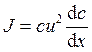 ;
;
г) 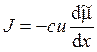 ; д)
; д) 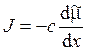 .
.


