Термодинамическая система
Надо иметь в виду, что работа и теплота не являются энергией или ее видом, а является лишь двумя способами передачи энергии, двумя способами обмена энергией. Они могут вызывать во взаимодействующих телах изменение движения материи любой формы.
1.2. Термодинамическая система
Термодинамической системой (ТС) называется совокупность тел, обменивающихся между собой и окружающей средой энергией и веществом. Объектом изучения может быть вещество — термодинамическое рабочее тело (ТРТ), как частный случай ТС, или совокупность тел, состоящая из источника тепла, холодильника, ТРТ и аккумулятора работы и составляющая ТС. Тела, не входящие в состав исследуемой ТС, объединяются общим понятием «окружающая среда». На границе ТС и окружающей среды происходит взаимодействие между ТС и окружающей средой, которое заключается в передаче энергии и вещества в ТС и из нее. Число воздействующих на ТС сил определяется числом степеней свободы ТС-N.
Если на ТС воздействуют только силы нормального давления – р и температуры – Т, т. е. число степеней свободы ТС N=2, то такая ТС называется простой или термодеформационной. Примером такой ТС может служить рабочее тело в цилиндре поршневого двигателя. Если число степеней свободы ТС N>2, то такие ТС называются сложными. Например, если кроме давления р и температуры Т на ТС воздействуют электрические и магнитные поля (N=4).
В зависимости от характера взаимодействия между ТС и окружающей средой, т. е. в зависимости от свойств границы между ТС и окружающей средой различают:
— закрытые или замкнутые термодинамические системы, если граница ТС непроницаема для вещества, т. е. отсутствует массообмен между ТС и окружающей средой;
— открытые термодинамические системы, если имеется массообмен между ТС и окружающей средой и через границу ТС переходит вещество;
— проточные термодинамические системы, как частный случай открытых ТС, когда на одних участках границы вещество входит в ТС, а на других участках границы выходит из ТС;
— изолированные ТС, когда границу системы не пересекают ни потоки вещества, ни потоки энергии;
— адиабатные ТС, когда система не обменивается с окружающей средой теплотой, т. е. термодинамическая система находится в тепловой изоляции.
В термодинамике обычно рассматриваются неподвижные макроскопические ТС в системе координат, связанной с центром масс ТС.
1.3. Вещество. Фазы. Агрегатные состояния
Под веществом понимается материя, обладающая массой покоя.
Чистое вещество – это вещество, состоящее из одинаковых структурных частиц, т. е. из частиц одинакового вида. При этом под частицами понимаются молекулы, атомы, положительные или отрицательные ионы, электроны.
Индивидуальным веществом называется чистое вещество в определенном фазовом состоянии. Например, С (графит), С (алмаз), С (газ).
Тела могут находиться в ТС в различных агрегатных состояниях: твердом (т), жидком (ж) и газообразном (г). Плазма с точки зрения термодинамики – это ионизированный газ со специфическими свойствами. Пар – это газ, контактирующий со своей конденсированной фазой, и деление на пар и газ является условным. Примеры обозначения агрегатного состояния: СО2 (т), Н2О (ж), Н2О (г).
Фаза – это гомогенная часть гетерогенной ТС, ограниченная поверхностью раздела. Гетерогенная ТС – это ТС, состоящая из двух и более фаз.
Гомогенная ТС – это ТС, между любыми частями которой нет поверхностей раздела. Гомогенная ТС, во всех частях которой свойства системы одинаковые, называется однородной ТС.
Фаза, содержащая одно вещество, называется чистой фазой.
Конденсированная ТС – это ТС, состоящая только из твердых и жидких фаз.
Многокомпонентрая ТС – это ТС, состоящая из двух и более индивидуальных веществ (компонентов ТС). Такими ТС являются растворы, сплавы и смеси. Если в фазе находится несколько газообразных веществ, то это газовая смесь.
1.4. Состояние термодинамической системы. Параметры и функции состояния.
Состояние рассматриваемой ТС определяется совокупностью физических величин, характеризующих данную ТС. По изменениям этих величин можно проследить за изменениями в ТС при ее взаимодействии с окружающей средой.
Состояние ТС является равновесным, если в ТС наблюдается равномерное распределение физических величин. Так, для простой ТС во всех ее точках должны быть одинаковыми температура и давление. Если в ТС идут процессы выравнивания неравномерностей физических величин, то состояние системы является неравновесным. Состояние ТС изменяется в результате обмена энергией и массой между ТС и окружающей средой.
Параметрами и функциями состояния ТС называют физические величины, значения которых не зависят от пути, по которому ТС пришла в данное состояние, т. е. от предыстории ТС. К параметрам состояния относятся величины, которые имеют простую физическую природу и могут быть непосредственно измерены: температура Т, давление р, плотность r и удельный объем v. Эти параметры выражают интенсивные свойства. Функции состояния имеют сложную физическую природу и не могут быть непосредственно измерены. К ним относятся: внутренняя энергия U, энтальпия Н, энтропия S и другие величины.
На ТС при взаимодействии ее с окружающей средой действуют термодинамические силы, которые называются потенциалами термодинамических воздействий или обобщенными силами. К ним относятся механические силы: давление р [Па], касательное напряжение рt [Па], сила F [Н] и обобщенные силы немеханического характера: температура Т [К], напряженность магнитного поля Н [А/м], напряженность электрического поля Е [В/м].
Каждой обобщенной силе соответствует обобщенная координата. Обобщенными координатами называются параметры состояния, изменяющиеся при наличии взаимодействия данного рода. Так для простой ТС обобщенной силе – давлению р соответствует обобщенная координата – объем v, поскольку перемещение поршня приводит к изменению объема ТС. Для обобщенной силы – температуры Т роль обобщенной координаты выполняет энтропия S [Дж/К].
Различие значений обобщенной силы на границе между ТС и окружающей средой приводит к взаимодействию данного рода, т. е. к передаче энергии в данной форме. Это необходимое условие возникновения в ТС различных процессов: теплообмена и различных видов работ.
Все физические величины, характеризирующие ТС, подразделяются на независимые, которые задаются, и зависимые, которые вычисляются через известные параметры, а также на калорические и термические, интенсивные и экстенсивные, полные и относительные.
Калорические величины – это величины, которые выражаются в единицах энергии. Например: внутренняя энергия U[Дж], энтропия S[Дж/К], теплота Q [Дж], работа L [Дж], теплоемкость С [Дж/К] и др. Термические величины – это величины, чей физический смысл не связан непосредственно с понятием энергии. Например: термодинамическая температура Т [К], давление р [Па] и др.
Параметры, не зависящие от количества вещества ТС, выражают интенсивные свойства ТС. К ним относится:
1. термодинамическая температура Т,[К] (абсолютная термодинамическая шкала температур Кельвина), которая связана с эмпирической шкалой температур Цельсия t,0С (стоградусная международная температурная шкала) формулой:
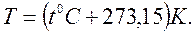
Абсолютная термодинамическая шкала температур определяется с помощью тройной точки воды в качестве реперной точки со значением 273,15К, а нижней границей шкалы служит абсолютный нуль температур.
Эмпирической температурой называется мера отклонения тела от состояния теплового равновесия с тающим льдом, находящимся под давлением в 1 физическую атмосферу. Измеряется эта температура термометрами: ртутным, спиртовым, газовым и др. На термометре наносят исходные опорные точки-реперы, отвечающие устойчивым тепловым состоянием: таяния льда (00С) и кипения воды (1000С) при р=1 физ. атм.
Эмпирическая шкала температур Фаренгейта имеет реперную точку при температуре тающей смеси равных долей льда и нашатырного спирта, которая принимается за 00F. Эта точка лежит на 320 F ниже 00С, а интервал от 00С до 1000С соответствует 1800F. Таким образом, шкала Цельсия связана со шкалой Фаренгейта формулой:
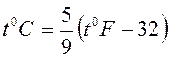 .
.
Цена деления шкалы Реомюра больше, чем шкалы Цельсия, т. к. интервал от 00С до 1000С разбит на 80 частей.
2. Термодинамическое абсолютное давление:
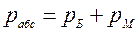 ,
, 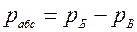 , [Па]
, [Па]
где рМ — манометрическое (избыточное) давление, измеряемое манометром; рБ – барометрическое (атмосферное) давление, измеряемое барометром; рВ – давление, измеряемое вакуумметром (избыток барометрического давления над абсолютным давлением).
Давление газа р численно равно силе, действующей на единицу площади поверхности и направленной по нормали к стенкам оболочки, в которой заключен газ. В системе СИ давление измеряется в Ньютонах на м2 или Паскалях, т. е. 1Н/м2=1Па. Связь с другими системами единиц:
1техн. атм = 0,968физ. атм = 9,81×104Па = 1кгс/см2 = 104кгс/м2 = 735ммНg =
= 10000,3ммН2О = 0,981бар.
3. Удельный объем рабочего тела v=V/m, м3/кг, где V, м3– объем ТС; m, кг – масса ТС.


