Уравнение майера
Если ТС – однородное рабочее тело, то в расчетах применяются относительные теплоемкости:
— удельная теплоемкость – теплоемкость, отнесенная к 1 кг вещества с=С/m, Дж/кгК;
— молярная теплоемкость – теплоемкость, отнесенная с 1 молю вещества 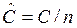 , Дж/мольК;
, Дж/мольК;
— объемная теплоемкость – теплоемкость, отнесенная к 1м3 вещества 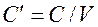 , Дж/м3К.
, Дж/м3К.
Теплоемкость – функция процесса и зависит от рода рабочего тела, характера процесса и параметров состояния. Так, теплоемкость в процессе с постоянным давлением называется изобарной теплоемкостью:
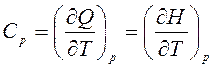 ,
,
где H, Дж – энтальпия.
Теплоемкость в процессе с постоянным объемом называется изохорной теплоемкостью:
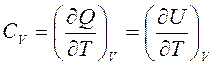 ,
,
где U, Дж – внутренняя энергия.
Теплоемкость идеального газа не зависит от температуры и давления и зависит только от числа степеней свободы движения молекул и в соответствии с законом о равном распределении энергии по степеням свободы движения молекул теплоемкость: 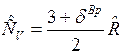 , где
, где ![]() — вращательные степени свободы, равные для одноатомного газа нулю
— вращательные степени свободы, равные для одноатомного газа нулю  , для двухатомного газа —
, для двухатомного газа — ![]() =2 и для трехатомных газов
=2 и для трехатомных газов ![]() =3;
=3; 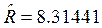 Дж/мольК – молярная газовая постоянная. Теплоемкость
Дж/мольК – молярная газовая постоянная. Теплоемкость ![]() определяется по уравнению Майера:
определяется по уравнению Майера:
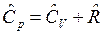 .
.
Для одноатомного газа 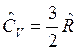 и
и 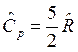 , для двухатомного газа
, для двухатомного газа 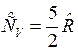 и
и 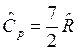 , для трех и более атомных газов
, для трех и более атомных газов 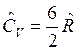 и
и 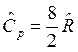 .
.
Теплоемкость реальных газов зависит от давления и температуры. В ряде случаев можно пренебречь влиянием давления на теплоемкость и принять, что теплоемкость реальных газов зависит только от температуры: C=f(t). Эта зависимость определяется экспериментально.
Эмпирическая зависимость удельной истинной теплоемкости от температуры может быть представлена в виде многочлена:
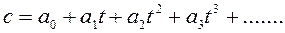 , Дж/кгК,
, Дж/кгК,
где 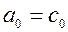 при температуре t=00C. Для двухатомных газов можно ограничиться двумя слагаемыми:
при температуре t=00C. Для двухатомных газов можно ограничиться двумя слагаемыми: 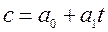 , или
, или 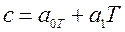 , где
, где 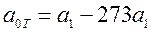 .
.
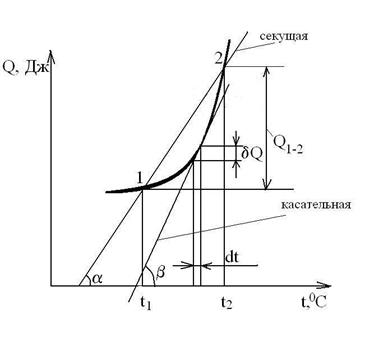
Для конечного участка процесса 1-2 количество теплоты равно:
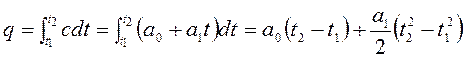 .
.
Тогда средняя теплоемкость на этом участке процесса будет равна:
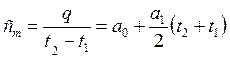 , Дж/кгК.
, Дж/кгК.
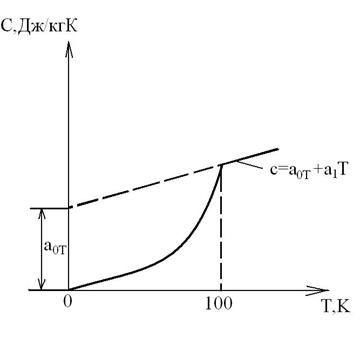
В области низких температур при Т<100К прекращается вращательное движение молекул и колебательное движение атомов, а при температуре Т→0К прекращается и поступательное движение молекул, т. е. при Т=0К Ср=Cv=0 и прекращается тепловое движение молекул (опытные данные Нернста и др., 1906-1912гг.). При температуре Т→0К свойства веществ перестают зависеть от температуры, как это иллюстрируется на приведенном графике зависимости теплоемкости от абсолютной температуры.
4.2. Уравнение Майера
Уравнение Майера связывает между собой теплоемкости идеального газа в процессах p=const и v=const. Для удельных теплоемкостей сp и сv эта связь получается из рассмотрения формулы, являющейся определением функции состояния-энтальпии:
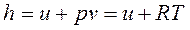 , Дж/кг.
, Дж/кг.
Тогда дифференциал ![]() , а производная энтальпии по температуре при
, а производная энтальпии по температуре при 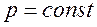 равна:
равна:
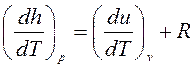 , где R— удельная газовая постоянная, зависящая от рода газа, или
, где R— удельная газовая постоянная, зависящая от рода газа, или 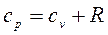 , Дж/кгК, или
, Дж/кгК, или 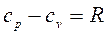 .
.
Для молярных теплоемкостей эта связь имеет вид: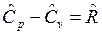 , Дж/мольК, так как
, Дж/мольК, так как ![]() ,
, 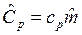 и
и 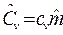 , где
, где ![]() — молярная масса, кг/моль.
— молярная масса, кг/моль.
Для n молей вещества получим связь
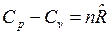 , Дж/К,
, Дж/К,
где n – количество вещества, моль; ![]() и
и 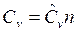 — общие теплоемкости термодинамических процессов при постоянных давлении и объеме соответственно.
— общие теплоемкости термодинамических процессов при постоянных давлении и объеме соответственно.
Отношение изобарной теплоемкости к изохорной теплоемкости называется показателем адиабатного процесса:
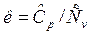 .
.


