Занятие по квантовой физике
атом бора
2. спектры излучения газов
2.1 Экспериментальные данные
При любом из электрических разрядов газ излучает свет. Спектр излучения представляет собой линии. При очень высоких температурах, когда большая часть газа ионизирована, ясно наблюдается и непрерывная компонента спектра.
Вопрос 1. Как можно получить спектр излучения? Почему свет в спектре разделяется на линии, а не на световые пятна какой-нибудь другой формы?
Вопрос 2. Что можно сказать о длинах волн света с линейчатым спектром? Что можно сказать о длинах волн света с непрерывным спектром?
При электрическом разряде часть молекул диссоциирует на атомы, часть ионизируется. Как показали исследования, линейчатую часть спектра дают не молекулы, а атомы.
Вопрос 3. Можно ли получить линейчатый спектр от куска металла (например, меди или железа)?
Спектры элементов неповторимы. У каждого элемента свой порядок расположения линий: определенный набор длин волн, распределение относительной яркости линий. На этом основан спектральный анализ веществ. Если испарить сложное вещество и осуществить электрический разряд через пар, то спектр излучения будет представлять собой наложение спектров всех элементов, входящих в состав исходного вещества. Причем яркость каждой составляющей компоненты пропорциональна доли атомов соответствующего элемента, имеющегося в паре вещества.
2.2 Комбинационный принцип Ритца
При наблюдении спектров бросается в глаза порядок, скрытая закономерность расположения линий. Эти закономерности пытались найти физики конца прошлого, начала настоящего века. Наконец, Ритцем в 1908 г. был установлен комбинационный принцип. По этому принципу все частоты wn, или волновые числа kn, спектральных линий могут быть представлены в виде разности двух величин, которые назвали термами. Каждый элемент имеет свой набор термов. Принцип дает возможность из знания ряда частот спектральных линий данного элемента делать предсказания о существовании других линий этого элемента. Составляя различные комбинации термов, можно найти все возможные частоты спектральных линий.
Наиболее простой оказалась закономерность расположения термов атома водорода. Бальмер эмпирическим путем подобрал формулу, дающую распределение частот видимого света, излучаемого атомом водорода (серия Бальмера) —
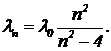 , (1)
, (1)
где l0=364,57 нм, n — ряд последовательных целых чисел: 3, 4, 5, и т. д. Позднее Ридберг придумал более ясную формулу для частоты излучения:
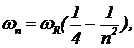 (2)
(2)
где wR=2,066×1016 с-1— постоянная Ридберга.
Задача 1. Рассчитайте первые три самые короткие длины волн серии Бальмера. К какой части шкалы электромагнитных волн относятся найденные длины?
При исследовании ультрафиолетовой части спектра Лайман нашел другую серию линий. Она описывается формулой
(3)
Еще позднее Пашен с Ритцем обнаружили серию линий излучения атома водорода в инфракрасной области спектра, описываемую формулой
(4)
В конце концов Ритц вывел обобщенную формулу Бальмера, дающую частоты всевозможных серий линий спектра атома водорода, которые так или иначе позднее были в экспериментах обнаружены 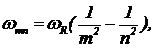 (5) где m — номер серии, n — номер линии в серии; n>m.
(5) где m — номер серии, n — номер линии в серии; n>m.
Задача 2. Используя комбинационный принцип Ритца, предложите формулу для системы термов, дающую весь спектр излучения атома водорода.
3. Теория Бора атома водорода
3.1 Модель атома Томсона
Физики начала века предпринимали неоднократные попытки построения физической картины, объясняющей системы термов элементов. Основная идея этих попыток заключалась в следующем. Атом рассматривался как колебательная система со многими степенями свободы. Такая система имеет набор собственных частот. Как, например, два связанных маятника (две степени свободы) имеют две нормальные моды с двумя разными частотами. В состав атомов входят заряженные частицы — электроны. В результате ускоренного движения при совершении электронами собственных колебаний происходит излучение электромагнитной волны с частотой колебаний электронов.
Предлагаемые схемы имели по крайней мере две трудности. Во-первых, из этих схем никак не следовал комбинационный принцип Ритца. Во-вторых, даже для такой простой атомной системы — для атома водорода — не удавалось получить более одной собственной частоты. В то время общепринятой моделью атома была модель Томсона. Согласно ей, атом представлял собой прозрачную для электронов равномерно заряженную каплю, в которой свободно могли двигаться без трения электроны. Одно из преимуществ этой модели состояло в устойчивости такой системы.
Задача 3. Предположите, что атом водорода представляет собой прозрачную для электрона равномерно заряженную сферическую каплю радиуса b с зарядом +e. Внутри этой капли может свободно колебаться электрон. Какую частоту должна иметь электромагнитная волна, излучаемая этим атомом? Определите радиус капли, полагая, что излучаемая электромагнитная волна имеет частоту
3.2 Квантовая гипотеза Планка
Во времена исследований, описываемых в предыдущем разделе, перед физиками стояла еще одна проблема, не поддававшаяся решению. В состоянии теплового равновесия хаотически колеблющиеся молекулы излучают и поглощают электромагнитные волны. Скорость излучения равна скорости поглощения. Энергия некоторым образом распределяется между излучением и механическим движением молекул. Излучение, находящееся в тепловом равновесии с веществом, назвали равновесным излучением. Исследуя спектр равновесного излучения, физики установили ряд закономерностей. Например, яркость разных участков спектра распределена неравномерно. Имеется самый яркий участок (максимум яркости солнечного излучения приходится на зеленый цвет), яркость спадает в области низких и в области высоких частот. Распределение яркости по спектру описывается некоторым универсальным семейством функций, переходящих из одной в другую путем однородных деформаций графика по оси частот. Найденные закономерности никак не могли быть объяснены с классических позиций.
М. Планку удалось подобрать математическую формулу, описывающую распределение яркости спектра. Позднее он нашел ограничение, налагаемое на поглощение и излучение электромагнитной волны веществом, учет которого позволил получить подобранную формулу из физических принципов. Ограничение заключалось в том, что при поглощении и излучении электромагнитной волны частоты w происходит дискретный обмен энергией между веществом и излучением: E=n ћw, (5)
где n — целое число, ћ=1,05×10-34 Дж×с — постоянная Планка. Это ограничение, в свою очередь, означает, что электромагнитная волна с частотой w может иметь энергию, только кратную ћw.
Гипотеза Планка открыла новую страницу современной физики.
Задача 4. Какую энергию имеет электромагнитная волна излучения атома водорода, дающая оранжевую линию спектра, l=600 нм (в электронвольтах)?
3.3 Боровская теория атома водорода
Молодой датский физик Нильс Бор приехал в Кавендишскую лабораторию в Англии, которой тогда руководил уже известный в то время Резерфорд. На Бора большое впечатление произвели результаты опытов Резерфорда по рассеянию a-частиц на атомах золота. После взаимодействия a-частицы двигались так, как должны двигаться при рассеянии на частице с сосредоточенными в очень малой по размерам области зарядом и массой. Из опытов следовало, что атом похож на ядро-Солнце с движущимися вокруг него электронами-планетами. [Сам Резерфорд был в восторге от результатов. Под сильным впечатлением от опытов он говорил: “Теперь я знаю, как выглядит атом!”.]
Вопрос 4. Как, на ваш взгляд должны были бы быть распределены по направлениям рассеянные a-частицы, если бы была правильной модель атома Томсона? В чем должно быть главное отличие картины рассеяния соответствующей планетарной модели атома?
Для всех физиков было абсолютно непонятно, как может быть устойчивым атом в планетарной модели. Даже двигаясь по круговой траектории, электрон должен излучать. По расчетам Лоренца, все электроны в атоме должны попадать на ядро в течение 10-8 с. Планетарный атом не может быть устойчивым.
Бор построил модель атома водорода, которая не противоречила результатам опытов Резерфорда и согласовывалась с комбинационным принципом. В основу своей теории Бор положил следующие утверждения (постулаты):
— электрон в атоме движется по стационарным круговым орбитам;
— на стационарных орбитах момент импульса L может принимать значения L n=nћ (момент импульса квантуется);
— атом излучает или поглощает электромагнитную волну при переходе с одной стационарной орбиты на другую, и энергия излучения равна Em-En.
Устойчивость атома Бором просто постулировалась.
Задача 5. Опираясь на постулаты Бора:
а) найдите зависимость полной энергии электрона в атоме водорода от угловой скорости движения по круговой орбите;
б) используя правило квантования энергии электрона в атоме Ln=nћ, получите формулу для возможных значений энергии электрона;
в) определите радиус первой (n=1) орбиты электрона;
г) выведите формулу для возможных значений энергии излучения атома водорода (проверьте, получается ли обобщенная формула Бальмера);
д) чему равна энергия ионизации атома водорода (в электронвольтах)?


