Химическое равновесие в смеси идеальных газов
Исходные данные.
|
Вещество |
|
|
|
|
a |
b, |
c, |
|
н-C4H10 |
1,4 |
-126,15 |
310,12 |
97,45 |
11,32 |
122,01 |
-37,90 |
|
C2H4 |
1,3 |
52,30 |
219,45 |
43,56 |
18,23 |
303,56 |
-92,65 |
|
н-C6H14 |
1,5 |
-167,19 |
388,40 |
143,09 |
8,66 |
505,85 |
-184,43 |
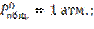
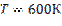 ;
;
![]()
1. 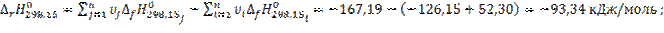
2. 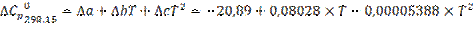
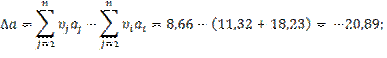
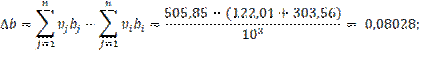
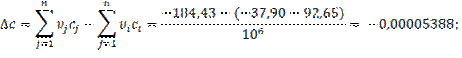
3. 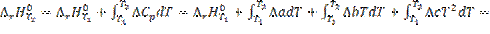
![]()
![]()
где:
![]()
![]()
при 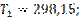
4. Зависимость 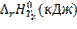 от
от ![]()
|
|
|
|
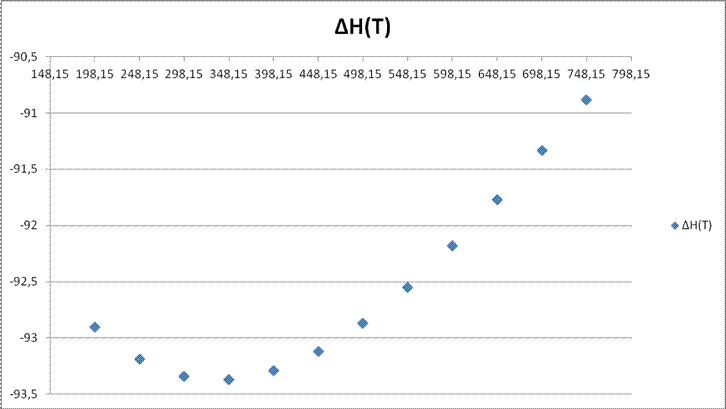
198,15 |
92,9069 |
|
248,15 |
93,1904 |
|
298,15 |
-93,34 |
|
348,15 |
93,3693 |
|
398,15 |
93,2916 |
|
448,15 |
93,1205 |
|
498,15 |
92,8695 |
|
548,15 |
92,5519 |
|
598,15 |
92,1813 |
|
648,15 |
91,7712 |
|
698,15 |
-91,335 |
|
748,15 |
90,8861 |
5. График зависимости 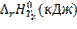 от
от ![]() .
.
6. 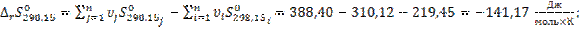
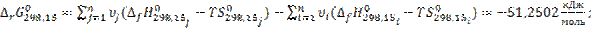
7. 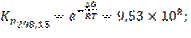
![]()
8. 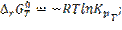
![]()
9. Зависимость ![]() от
от 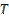
|
|
|
|
198,15 |
|
|
248,15 |
|
|
298,15 |
953103275 |
|
348,15 |
4265236,6 |
|
398,15 |
74336,879 |
|
448,15 |
3211,6086 |
|
498,15 |
262,19288 |
|
548,15 |
34,021035 |
|
598,15 |
6,2501533 |
|
648,15 |
1,5003839 |
|
698,15 |
0,44435 |
|
748,15 |
0,1556343 |
10. График зависимости ![]() от
от 
11. Зависимость 
|
|
|
|
|
198,15 |
139,326 |
-65,2994 |
|
248,15 |
140,613 |
-58,2971 |
|
298,15 |
-141,17 |
-51,2502 |
|
348,15 |
141,265 |
-44,1878 |
|
398,15 |
-141,06 |
-37,1286 |
|
448,15 |
140,657 |
-30,085 |
|
498,15 |
140,127 |
-23,065 |
|
548,15 |
139,521 |
-16,0736 |
|
598,15 |
138,874 |
-9,11358 |
|
648,15 |
138,216 |
-2,18632 |
|
698,15 |
137,568 |
4,708213 |
|
748,15 |
136,947 |
11,57095 |
12. 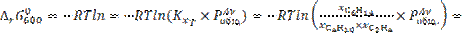
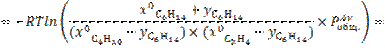
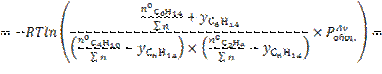
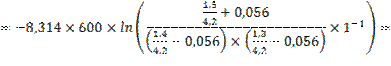
![]()
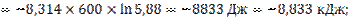
13. 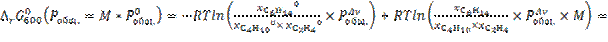
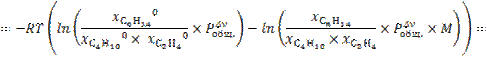
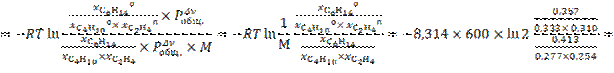
![]()
при изменении исходного давления газовой смеси в 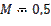 раз (уменьшении в 2 раза);
раз (уменьшении в 2 раза);
14. Расчёт равновесных давлений и концентраций для каждого компонента газовой смеси (см. исх. данные).
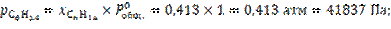
![]()
![]()
![]()
![]()
![]()
15. Выводы о влиянии давления и температуры на выход продуктов реакции на основании уравнений изотермы химической реакции, уравнения изобары Вант-Гоффа, а также на основании принципа Ле-Шателье.
Поскольку система, в которой протекает данная реакция, является гомофазной (газовая фаза), число молей газообразных веществ в правой части уравнения больше, и реакция – экзотермическая (тепловой эффект реакции в стандартных условиях меньше нуля), то для смещения равновесия в сторону продуктов необходимо повысить давление и уменьшить температуру. Вычисления при помощи уравнений изобары-изотермы Вант-Гоффа подтверждают эти предположения – при уменьшении давления и увеличении температуры энергия Гиббса растёт – становится более положительной (а значит, и возможность протекания реакции в прямом направлении становится менее вероятной).


