составление материального баланса процесса окисления
(1.16)
При составлении материального баланса процесса окисления отдельных горючих компонентов следует иметь в виду различие физического состояния веществ, участвующих в горении: содержания углерода, водорода, серы, азота, кислорода и влаги для жидкого и твердого состояния топлива обычно характеризуются процентами по массе, а окислитель (кислород), находящийся в газообразном состоянии, — процентами по объему. Анализ реакций горения позволяет это различие учесть.
В соответствии с реакцией полного горения углерода для окисления одного моля углерода массой 12 кг следует затратить один моль кислорода, имеющий объем 22,4 м3. Таким образом, на окисление 1 кг углерода расход кислорода составит 22,4 : 12 = 1,867 м3 ![]() С. Для окисления углерода в количестве, которое соответствует содержанию этого компонента в жидком и твердом топливе, потребуется кислорода:
С. Для окисления углерода в количестве, которое соответствует содержанию этого компонента в жидком и твердом топливе, потребуется кислорода:
|
|
(1.17) |
Поступая аналогичным образом, можно определить, что для окисления двух молей водорода массой 4 кг необходимо подвести для полного горения один моль кислорода, а для сжигания 1 кг водорода 22,4 : 4 = 5,6 м3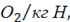 при этом для окисления водорода в соответствии с его содержанием в топливе Нр потребуется кислорода:
при этом для окисления водорода в соответствии с его содержанием в топливе Нр потребуется кислорода:
|
|
(1.18) |
Для окисления серы аналогично 22,4 : 32= 0,7 м3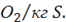 Здесь 32 масса одного моля серы в кг. В итоге:
Здесь 32 масса одного моля серы в кг. В итоге:
|
|
(1.19) |
Необходимо учесть, что кислород топлива Ор может либо участвовать в реакциях окисления, либо уже связан с горючими компонентами. При массе одного моля О2, равной 32 кг, объем 1 кг О2 составит 22,4 : 32 = 0,7 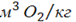 О или при содержании кислорода в топливе в количестве Ор:
О или при содержании кислорода в топливе в количестве Ор:
|
|
(1.20) |
Это количество кислорода должно быть вычтено из общего количества, необходимого для окисления углерода, водорода и серы.
Используя полученные сведения, можно составить уравнение материального баланса процесса горения и определить количество кислорода, необходимого для полного окисления горючих компонентов жидкого и твердого топлива – ![]()
Таким уравнением является:
|
|
(1.21) |
С учетом выражений (1.17) – (1.21) получим:
|
|
(1.22) |
Далее могут быть рассчитаны расходы сухого и влажного воздуха, обеспечивающих полное сжигание жидкого и твердого топлива в теоретических условиях, когда 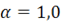 по выражениям (1.3) и (1.4), а также и в практических условиях, т. е. при α > 1,0, по выражениям (1.5) и (1.6).
по выражениям (1.3) и (1.4), а также и в практических условиях, т. е. при α > 1,0, по выражениям (1.5) и (1.6).
В общем случае горения жидкого и твердого топлива в теоретических условиях, когда 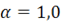 , выход продуктов горения – V0 представляет собой сумму объемов оксидов
, выход продуктов горения – V0 представляет собой сумму объемов оксидов ![]() ,
, ![]() водяного пара,
водяного пара, ![]() источниками которого являются продукты горения водорода, влага топлива
источниками которого являются продукты горения водорода, влага топлива ![]() и влага воздуха (дутья). Кроме того, в случае сжигания жидкого топлива его предварительно распыляют с помощью форсунок, используя для этой цели либо сжатый воздух, то после распыления его кислород участвует в процессах окисления горючих составляющих топлива. Если же для распыления, он смешивается с продуктами горения, увеличивая в них содержание водяного пара. При распылении жидкого топлива паром его расход характеризуется величиной
и влага воздуха (дутья). Кроме того, в случае сжигания жидкого топлива его предварительно распыляют с помощью форсунок, используя для этой цели либо сжатый воздух, то после распыления его кислород участвует в процессах окисления горючих составляющих топлива. Если же для распыления, он смешивается с продуктами горения, увеличивая в них содержание водяного пара. При распылении жидкого топлива паром его расход характеризуется величиной ![]() равной массе водяного пара – Мпар, отнесенной к 100 кг жидкого топлива и выраженной в процентах. Таким образом:
равной массе водяного пара – Мпар, отнесенной к 100 кг жидкого топлива и выраженной в процентах. Таким образом:
![]()
Азот в продукты полного горения жидкого и твердого топлива поступает и с топливом, и с кислородом воздуха.
Следовательно, суммарный объем продуктов полного горения будет равен:
|
|
(1.23) |
Отдельные слагаемые уравнения (1.23) будут:
из реакции окисления углерода следует, что из одного моля углерода массой 12 кг образуется один моль объемом 22,4 м3, т. е. в результате окисления 1 кг углерода образуется 22,4 : 12 = 1,867 м3 диоксида углерода, а объем ![]() будет равен:
будет равен:
|
|
(1.24) |
Объем диоксида серы – ![]() может быть рассчитан аналогичным образом. Тогда:
может быть рассчитан аналогичным образом. Тогда:
|
|
(1.25) |
Объем водяных паров – ![]() , может быть найден из анализа реакции окисления водорода и поступления паров воды с воздушным дутьем, а также из топлива и с распылителем.
, может быть найден из анализа реакции окисления водорода и поступления паров воды с воздушным дутьем, а также из топлива и с распылителем.
Так, при окислении одного моля водорода массой 2 кг образуется один моль водяных паров объемом 22,4 м3. Тогда в результате окисления 1 кг водорода образуется 22,4 : 2 = 11,2 м3 водяного пара:
|
|
(1.26) |
При испарении влаги топлива и распылителя из одного моля воды массой 18 кг образуется один моль пара объемом 22,4 м3. Тогда объем 1 кг влаги составит 22,4/18 = 1,244 м3 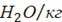 влаги, а объем влаги от указанных источников будет равен:
влаги, а объем влаги от указанных источников будет равен:
|
Рефераты по физике сдают здесь
Другие статьиУзнать стоимость за 15 минут
Распродажа дипломных
Подпишись на наш паблик в ВК
Нужна работа?
|


