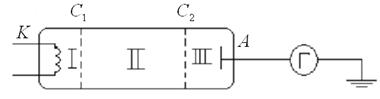
Радиус боровских орбит
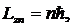 n= 1,2,3, … . (10.12)
n= 1,2,3, … . (10.12)
Данная формула была впервые постулирована астрофизиком Дж. Никольсоном в 1912 г. в его расчетах круговых орбит атомных электронов.
С учетом (10.12) энергия электрона (10.6) записывается в виде
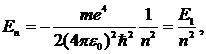 (10.13)
(10.13)
где наименьшая энергия
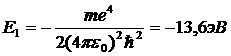 (10.14)
(10.14)
есть энергия основного состояния атома водорода. Таким образом, энергетический спектр стационарных состояний атома водорода с энергией E<0 является дискретным.
Радиус боровских орбит определяется выражением
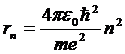 (10.15)
(10.15)
и быстро растет с увеличением n. Радиус орбиты основного состояния атома водорода (радиус первой боровской орбиты)
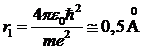 , (10.16)
, (10.16)
где 1Å=10-10м – внесистемная единица длины, называемая ангстрем.
В дальнейшем число n получило название главного квантового числа.
Энергетический спектр атома водорода приведен на рисунке 10.1. При Е<0 электрон совершает финитное (ограниченное в пространстве) движение и образует связанное (с протоном) состояние. Стационарные состояния с n>1 называются возбужденными. Точка E=0 на оси энергий является точкой сгущения для значений энергии дискретного спектра.
В области положительной энергии Е≥0 спектр является сплошным, т. е. энергия электрона вплоть до сколь угодно больших значений меняется непрерывным образом. При Е≥0 электрон совершает инфинитное (неограниченное в пространстве) движение. Переход электрона из связанного состояния дискретного спектра в состояние инфинитного движения сплошного спектра называется ионизацией атома водорода.
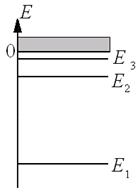
Рис.10.1
Второй постулат Бора определяет свойства процессов излучения и поглощения электромагнитных волн атомом и вводит понятие квантового скачка, когда в результате взаимодействия с окружающей средой электрон мгновенно переходит из одного стационарного состояния в другое. Рассмотрим взаимодействие атомам водорода с электромагнитным излучением. Если электрон переходит из состояния с большей энергией ![]() в состояние с меньшей энергией
в состояние с меньшей энергией ![]() , то при этом излучается фотон электромагнитной волны. Частота
, то при этом излучается фотон электромагнитной волны. Частота ![]() излучения определяется законом сохранения энергии
излучения определяется законом сохранения энергии
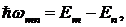
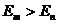 . (10.17)
. (10.17)
Если электрон переходит из состояния с меньшей энергией ![]() в состояние с большей энергией
в состояние с большей энергией ![]() , то в этом случае атом должен поглотить фотон той же частоты
, то в этом случае атом должен поглотить фотон той же частоты 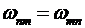 , которая входит в закон сохранения энергии (10.17).
, которая входит в закон сохранения энергии (10.17).
Линейчатые спектры излучения и поглощения атома водорода соответствуют переходам между энергетическими уровнями дискретного спектра (10.13). Все линейчатые спектры излучения можно сгруппировать в серии, которые задаются с помощью фиксированного нижнего энергетического уровня n, на который осуществляются переходы с более высоких энергетических уровней с m>n. Формулы для длин волн спектральных линий таких серий находятся с помощью формул (10.13) и (10.17).
Переходы с возбужденных уровней на основной уровень n=1 образуют серию Лаймана, относящуюся к ультрафиолетовой области спектра. Длины волн ![]() серии Лаймана определяются формулой
серии Лаймана определяются формулой
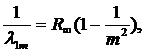
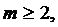 (10.18)
(10.18)
Здесь
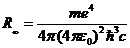 (10.19)
(10.19)
-постоянная Ридберга для случая неподвижного протона 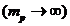 . Переходы на первый возбужденный уровень n=2 образуют серию Бальмера, длины волн которой лежат в видимой области спектра и описываются формулой Бальмера (10.11). Переходы на второй возбужденный уровень n=3 образуют серию Пашена – Бака, длины волн
. Переходы на первый возбужденный уровень n=2 образуют серию Бальмера, длины волн которой лежат в видимой области спектра и описываются формулой Бальмера (10.11). Переходы на второй возбужденный уровень n=3 образуют серию Пашена – Бака, длины волн ![]() удовлетворяют соотношению
удовлетворяют соотношению
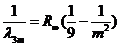 ,
, ![]() , (10.20)
, (10.20)
и принадлежат к инфракрасной области спектра.
Необходимо отметить, что в квантовой теории излучения атомов рассматриваются два типа переходов. Спонтанные (самопроизвольные) переходы с более высокого уровня на более низкий с излучением фотона, которые были введены А. Эйнштейном в 1916г. по аналогии с явлением естественной радиоактивности. Эти переходы происходят и в отсутствие внешнего электромагнитного поля на частоте перехода (10.17). Второй тип переходов – это вынужденные переходы, совершаемые только под воздействием внешнего электромагнитного поля на частоте перехода. Данные индуцированные внешним полем переходы могут происходить как с верхнего уровня на более низкий уровень с испусканием фотона, так и с низкого уровня на более высокий энергетический уровень с поглощением фотона. Понятие вынужденных переходов было введено А. Эйнштейном в 1916г. при анализе теплового равновесия между веществом и электромагнитным излучением. Вынужденное излучение возбужденных атомов лежит в основе работы лазера и определяет наиболее важные характеристики лазерного излучения.
Теория Бора относится к простейшему атому водорода и очень хорошо согласуется с экспериментальными исследованиями его спектров излучения и поглощения. Опыт показал, что представления о стационарных состояниях,
имеющих дискретные значения энергии, справедливы и для многоэлектронных атомов. В 1913г. Дж. Франк и Густав Герц поставили эксперимент, доказавший дискретность энергетического спектра многоэлектронного атома ртути, имеющего 80 электронов. В эксперименте исследовалась зависимость силы постоянного тока J от ускоряющего напряжения ![]() между катодом К и сеткой
между катодом К и сеткой ![]() (рис. 10.2). Между второй сеткой
(рис. 10.2). Между второй сеткой ![]() и анодом A приложено замедляющее напряжение
и анодом A приложено замедляющее напряжение ![]() . Напряжение между сетками
. Напряжение между сетками ![]() и
и ![]() равно нулю. Катод, анод и обе сетки помещены внутри стеклянного баллона, в котором находятся пары ртути и практически отсутствуют молекулы воздуха.
равно нулю. Катод, анод и обе сетки помещены внутри стеклянного баллона, в котором находятся пары ртути и практически отсутствуют молекулы воздуха.