Ферментативный катализ
Водородная связь-это взаимодействие между двумя электроотрицательными атомами, между которыми находится атом водорода. В качестве электроотр. атомов, являющимися донорами водорода могут выступать-атомы О, S, N. Вод. св. осуществляется в результате туннельного перехода между двумя электроотр. атомами. Энергия вод. св. от 10 до 30 кДж/моль. Неков. Вандер-вальс. взаимод.-это слабые взаимод. возникающие между электронейтральными атомами или молекулами, но облад. дипольн. свойствами. Диполи бывают постоянные(харак. нессиметричным расположением зарядов) и индуцированные. Сила ВдВ взаимод. обратно пропорциональна r4 степени расстояния между взаимодействующими частицами. Электорстат. взаимод. (полимерные или кулоновск).- взаимод. м/у электростатич. заряженными атомам или АК.
Третичная структура-это способ укладки в молекуле белка α цепей, β участков и т. д(простр. организации элементов вторичной структуры):глобула(водораств.); фибрилла(водонераств.).Эта структура стабилиз. ковалент. связью (дисульф. мостик),вод.,гидрофоб., ван-дер-вальсовые взаим., электростатич.(кулоновск.)взаимод., к-ые возник-ют м/у амк-ыми остатками, удаленными др. от др. по полип. цепи.
6.Третичн. структура-способ укладки в молекуле белка α цепей, β участков и т. д(простр. организации элементов вторичной структуры):глобула(водораств.); фибрилла(водонераств.).Эта структура стабилиз. ковалент. связью (дисульф. мостик), вод., гидрофоб., Ван-дер-Вальсовые взаим., электростатич. (кулоновск.) взаимод., к-ые возник-ют м/у амк-ыми остатками, удаленными др. от др. по полип. цепи.
Гидроф. взаим.-возникают между атомами или молекулами, для которых наиболее выгодно находится в контакте дрг с другом, чем в контакте с молекулами воды. Эти взаимод. носят энтропийный характер и связаны с упорядочиванием молек. воды в присутствии неполярных гидрофобных молекул. Четверт. структура имеется только в белках состоящих из неск. субъединиц. Это способ взаимной ориентации субъединиц. Она стабилиз. электростатич.,дисульф.,гидроф. взаим. Иногда выделяют пятеричн. уровень организации-способ организации надмолек. комплексов, белков выполн. одинак. функцию(метаболон). Свойства белков-прочность, гибкость, способность к тепловым деформациям, высокая хим. и биол. активность. Субъединица-структурная единица многосубъединичных белков построенная из одной полип. цепи.
7. Денатурац. и неденатурац. конфмармацион. переходы. Конформация молек. белка – это определенная с точностью до координат отдельных атомов структура молек. белка. Субъединица – структурная единица многосубъединичных белков построенная из одной полипеп. цепи. Домен-компактная структурная единица молек. белка, включающая часть полипеп. цепи. Сущ. Множество возможных вариантов укладки или сворачивания полип. цепи, однако реализуется 1 тип свертывания соответствующий миним. Энергии молек. белка. Этот тип свертывания характериз. наиб. стабильностью. 1Д=1а. е.м. Масса белков=5000Д-500000Д.
В активный центр молек. белка могут входить как аминокислоты находящиеся рядом по полип. цепи так и оказавшиеся сближенными в рез. Сворачивания полип. цепи. Неправильн. сворач. полип. цепи может привести к нарушению или полной потере функциональной активности, к развитию патологий. Молек. белка наход. в пост. движении — это так называемая конформац. подвижность. Функционирование молек. белка связано с определ. конформац. перестройками в его молекуле. Скорость катализируемых белком процессов определяется структурной подвижностью белка. Самый важный структурный переход в мол. белка-это переход между нативным и денатурированным состоянием. Денат. состояние-лишенное всякой структуры, так называемый, хаотич. клубок. Иследование процессов денатур. белков дает инф. о стабильности молек. белка. Метод изучающий процессы денат. нукл. кислот, белка назыв. микроколаметрией. Этот метод основан на регистрации количества тепла, выделяющегося в процессе денатур. белка(график). Денатурацию белка можно вызвать нагреванием, изменением РН, высокими конценрациями солей, взаимод. с ионами тяж. металлов. Денатур. молек. белка- фазовый переход 1рода, протекающий по принципу все или ничего т. е. напоминает процесс плавения кристалла.
8. Функции белков. Белковые макромолекулы представляют основные структурные компоненты клетки и межклеточных и внеклеточных образований. В клетке белки выполняют ряд важнейших функций:
1) Каталитическая, или ферментативная (избирательное связывание молекул субстрата и осуществление химических реакций. Белки могут ускорять химические реакции в 106 раз. Предполагают, что существует 200 000 белков);
2) Структурная (строительные компоненты клеточных и внеклеточных структур – коллаген, спектрин);Архитектура кл-ки определяется белковым цитоскелетом и липидными бислойными мембранами
3) Энергетическая (форма запасания питательных веществ);
4) Транспортная (альбумин, транспорин, гемоглобин, ферритин, Na+, К+-АТФаза);
5) Сигнальная, или информ-ая — белки — сигнальные мол-лы(инсулин, факторы роста, цитокины, рецепторы) восприним. клет-ые сигналы. Белки образуют сигнальные каскады переноса информации в клетке – родопсин, G-белки);
6) Механическая, или двигательная — ф-ия мышечного сокращения (белки-моторчики – актин и миозин, гиразы);
7) Защитная (иммунная – антитело)- иммуноглобулины, МНС, рецепторы на иммунокомпетентных клетках.
8) Регуляторная (регуляторы многообразных клеточных процессов – роста, дифференцировки, пролиферации, экспрессию ген. инф-ии.).
9.Ферментативный катализ, ур-ние Михаэлиса-Ментона: Ферменты—специализированные белки с высокой скоростью катализирующие взаимосвязанные хим. реакции, включая синтез, распад и взаимопревращение орг-их соединений, в ходе которых запасается и преобразуется хим. энергия. Основные признаки ферментов: 1)Высокая эффективность 2)Каталитической активностью (при t=37о и рН=7,4)3)Специфичность действия 4) Ускоряют протекающие очень медленно хим. реакции, не смещая их равновесие.Особенности ферм. катализа:1)Ферменты в клетке функционируют в малых конц.2)Ферм. не сдвигают полож. равновесия хим. р-ции, увеличивая только ее скорость 3)Ферменты не изменяются в ходе р-ции.
Апофермент—белковая часть ферментов, для проявления каталитической активности которых необходимо присутствие и небелкового компонента — кофермента. Апофермент определяет специфичность (избирательность) действия фермента и возможность регуляции его активности. Коферменты — органические соединения небелковой природы, входящие в состав некоторых ферментов. Соединяясь с апоферментом, коферменты образуют каталитически активные комплексы. Многие коферменты-производные витаминов (В1, В2, В6 РР и др.) Простетическая группа- (от греч. prosthetikos — прибавляющий), небелковая часть молекул сложных белков, в т. ч. ферментов. Может иметь различную химическую природу: от атомов металлов до нуклеотидов.Кинетика ферментативных процессов:
k1
А+В↔C
k-1
k1 и k-1 это константы прямой и обратнои реакций.Кравн=[С]/ [АС] [ВС]
К=k-1/k1
В основе современной теории ферментативного катализа лежит теория, разработанная Михаэлисом и Ментоном. В основе этой теории лежит представление об образовании фермент-субстратного комплекса:
k-1 k2
E+S↔ES→EX→EP→E+P
k1
Е — фермент; S — субстрат; ЕS-ферм.-субстр. комплекс;ЕР-комплекс фермент продукт;k1-скорость образования ферм-субстр комплекса ; k2-скорость обр. комплекса продукт — фермент.
Уравнение Михаэлиса-Ментона:
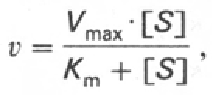
Кm=k-1+k2/k1
На основании ур-ния М-М можно определить 2 осн. параметра:Vmax и Кm. Для их одновременного определения используют графики М-М и Лайнуивера-
Берка. График М-М 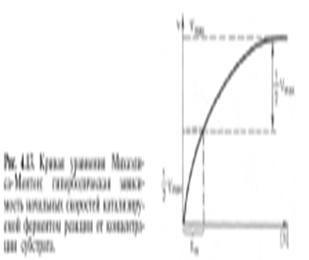
Кm численно равно концентрации субстрата при кот. V ферм. реакции равна 12 от Vmax Кm представляет собой константу равновесия ферм-субстр. комплекса и хар-ет сродство фермента к субстрату.
Уравнения Лайнуивера–Бэрка
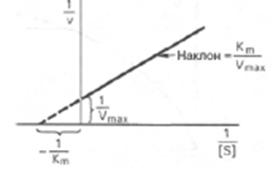
10. Механизмы ингибирования. Специфическое регулирование ферм. активности достигается использованием в клетке м-л эффекторов, ускоряющих либо ингибирующих ферм. катализ. Неспецифическое регулирование происходит путем изменения физ-хим условий среды. Регуляция ферм. активности может достигатся также путем 1)экспрессии генов 2)фосфорилирования и дефосфорилирования. Типы ингибиторов:1)конкурентный тип— конкурирует за связывание с субстратом
2)неконкурентный— не конкурирует с субстратом, не изменяет Кm
3)бесконкурентный— в одинаковой степени уменьшает Км и Vmax
Аллостерические регуляторы— это регуляторы взаимод. с ферментом в центре отличном от активного.
Энергия активации-это энергия необхадимая для достижения активированного состояния.(тот избыток энергии которым они должны обладать чтобы вступить в реакцию. Фермент снижает Еа увеличивая число активирующих м-л, становящихся реакционно способными на более низком энергетическом уровне (характерно наличие 2 переходных состояний ES и EP) E+S↔ES→EX→EP→E+P


